Cho hỗn hợp X gồm CuO và NaOH có tỉ lệ số mol 1:1 tá

MỤC LỤC
Câu hỏi:
Cho hỗn hợp X gồm CuO và NaOH có tỉ lệ số mol 1:1 tác dụng vừa đủ với dung dịch hỗn hợp HCl 1M và H2SO4 0,5M thu được dung dịch Y chỉ chứa m gam hỗn hợp muối trung hòa. Điện phân dung dịch Y với điện cực trơ, màng ngăn xốp cường độ I = 2,68A đến khi khối lượng dung dịch giảm 20,225 gam mất t giây thì dừng lại, thu được dung dịch Z. Cho m gam Fe vào dung dịch Z sau khi phản ứng kết thúc thu được 0,9675m gam hỗn hợp 2 kim loại. Hiệu suất điện phân 100%. Giá trị của t gần nhất với:
Đáp án án đúng là: A
Lời giải chi tiết:
- X (x mol CuO, x mol NaOH) + V lít ( HCl 1M và H2SO4 0,5M) → dung dịch Y chỉ chứa muối trung hòa.
→ Phản ứng xảy ra vừa đủ
Áp dụng bảo toàn điện tích → V + 0,5V.2 = 2x + x → V = 1,5x
→ m = 64x + 23x + 35,5.1,5x + 96.0,5.1,5x = 212,25x
- Điện phân dung dịch Y → dung dịch Z (Phản ứng với Fe→ 2 kim loại)
→ Chứng tỏ phản ứng điện phân còn dư Cu2+
Khối lượng 2 kim loại thu được < Khối lượng Fe cho vào → Chứng tỏ trong dung dịch chứa H+, ở anot H2O đã bị điện phân
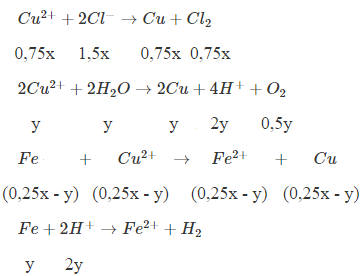
→ m - 0,9675m = 56.(y + 0,25x - y) - 64.(0,25x - y)
→ 64y - 2x = 0,0325m = 0,0325.212,25x → y = 0,139x
Có mdd giảm=mCu+mCl2+mO2
mdd giảm=64.(0,75x+y)+71.0,75x+32.0,5y=20,225g
→{x=0,18y=0,025
t=(0,75.0,18+0,025).2.965002,68=11523s
Xem thêm các bài tiếp theo bên dưới
- Khi sục từ từ khí CO2 vào dung dịch Ca(OH)2. Đ
- Cho hỗn hợp E gồm tripeptit X có dạng Gly−M−M (được tạo nên t
- Peptit X CxHyOzN6 mạch hở tạo bởi một α-amino axit no chứ
- Hỗn hợp T gồm 3 este mạch hở X, Y, Z. Trong đó $\large M_{X} < M_{Y} <
- Trong diêm, photpho đỏ có ở đâu? Thuốc gắn ở đầu que diêm Thuốc quẹt ở