-Phương trình hóa học minh họa \[Fe + 2HCl \to FeC{l_2} +
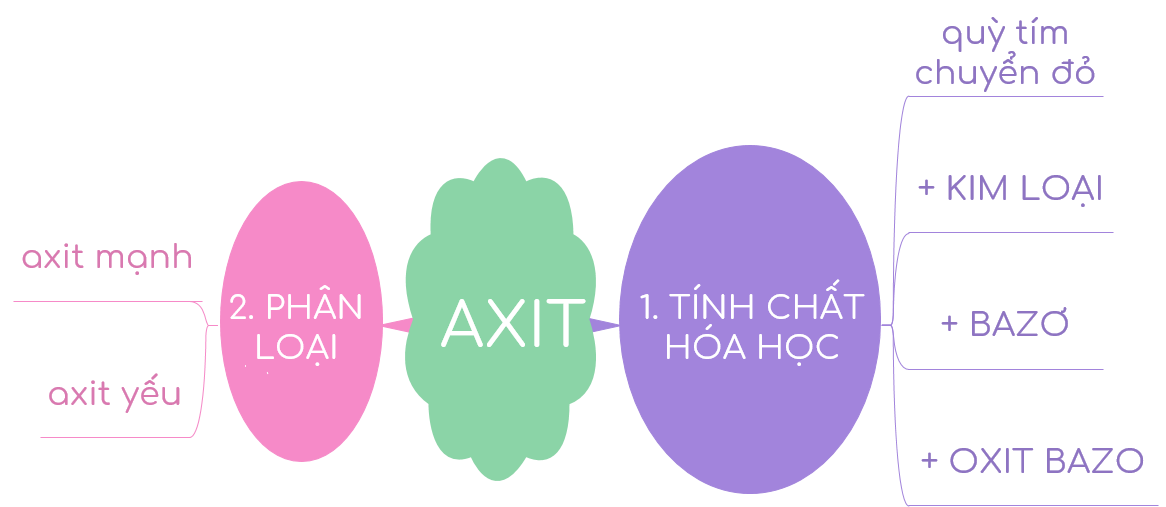
Lý thuyết về -Phương trình hóa học minh họa \[Fe + 2HCl \to FeC{l_2} +
-Phương trình hóa học minh họa
Fe+2HCl→FeCl2+H2
NaOH+HCl→NaCl+H2O
CuO+HCl→CuCl2+H2O
-Phân loại
axit mạnh: HCl,H2SO4,HNO3...
axit yếu: H2SO3,H2CO3,H2S...
Bài tập tự luyện có đáp án
Câu 1: Kẽm tác dụng với dung dịch axit clohiđric sinh ra
- A
- B
- C
- D
Kẽm tác dụng với dung dịch axit clohiđric sinh ra: dung dịch kẽm (II) clorua không màu và khí hiđro cháy được trong không khí cho H2 tác dụng với oxi.
Zn+2HCl→ZnCl2+H2
Câu 2: Nhóm chất tác dụng với nước và với dung dịch HCl là
- A
- B
- C
- D
Nhóm chất tác dụng với nước và với dung dịch HCl là: CaO,BaO,Na2O
CaO+H2O→Ca(OH)2CaO+2HCl→CaCl2+H2OBaO+H2O→Ba(OH)2BaO+2HCl→BaCl2+H2ONa2O+H2O→2NaOHNa2O+2HCl→2NaCl+H2O
Câu 3: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là
- A
- B
- C
- D
Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là: Zn, Fe, Al
Axit HCl, H2SO4 loãng tác dụng được với các kim loại đừng trước H trong dãy hoạt động hóa học của kim loại.
Dãy hoạt động hóa học của kim loại là:
K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Câu 4: Dãy chất tác dụng với dung dịch H2SO4 loãng tạo thành dung dịch có màu xanh lam?
- A
- B
- C
- D
Dãy chất tác dụng với dung dịch H2SO4 loãng tạo thành dung dịch có màu xanh lam: CuO,Cu(OH)2 . Dung dịch xanh lam là muối đồng (II).
Kim loại Cu không tác dụng với H2SO4 loãng
CuO+H2SO4→CuSO4+H2OCu(OH)2+H2SO4→CuSO4+2H2O
Câu 5: Dung dịch axit mạnh không có tính chất nào sau đây?
- A
- B
- C
- D
Dung dịch axit mạnh không có tính chất: tác dụng với oxit axit tạo thành muối và nước
Câu 6: Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng là
- A
- B
- C
- D
Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng: BaCl2,Ba(NO3)2
Chất kết tủa trắng là BaSO4
BaCl2+H2SO4→BaSO4↓+2HClBa(NO3)2+H2SO4→BaSO4↓+2HNO3
Câu 7: Chất nào sau đây khi tan trong nước cho dung dịch, làm quỳ tím hóa đỏ?
- A
- B
- C
- D
Chất khi tan trong nước cho dung dịch, làm quỳ tím hóa đỏ : SO3
Do khi SO3 tan trong nước tạo ra axit sunfuric làm cho quỳ tím hóa đỏ
SO3+H2O→H2SO4
Câu 8: Dãy các kim loại đều tác dụng với dung dịch axit clohiđric:
- A
- B
- C
- D
Dãy các kim loại đều tác dụng với dung dịch axit clohiđric: Al, Fe, Mg, Zn
Axit HCl, H2SO4 loãng tác dụng được với các kim loại đừng trước H trong dãy hoạt động hóa học của kim loại.
Dãy hoạt động hóa học của kim loại là:
K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Câu 9: CuO tác dụng với dung dịch H2SO4 tạo thành dung dịch
- A
- B
- C
- D
CuO tác dụng với dung dịch H2SO4 tạo thành dung dịch muối đồng (II) có màu xanh lam
CuO+H2SO4→CuSO4+H2O
Câu 10: Sản phẩm thu được khi cho sắt tác dụng với axit sunfuric loãng là
- A
- B
- C
- D
Sản phẩm thu được khi cho sắt tác dụng với axit sunfuric loãng là: Sắt (II) sunfat và hiđro: Fe+H2SO4→FeSO4+H2
Câu 11: Phản ứng của cặp chất nào sau đây tạo ra chất kết tủa trắng?
- A
- B
- C
- D
Phản ứng của các cặp chất tạo ra chất kết tủa trắng: BaCl2 và H2SO4 . Kết tủa trắng là BaSO4
BaCl2+H2SO4→BaSO4↓+2HCl
Câu 12: Tính chất hóa học nào không phải của axit?
- A
- B
- C
- D
Tính chất hóa học không phải của axit là: Tác dụng với oxit axit.
Axit không phản ứng với oxit axit.
Câu 13: Dãy chứa chất không tác dụng được với dung dịch H2SO4 loãng là
- A
- B
- C
- D
Dãy chứa chất không tác dụng được với dung dịch H2SO4 loãng là: Cu, CuO, Cu(OH)2 do Cu đứng sau H trong dãy hoạt động hóa học.
Xem thêm các bài tiếp theo bên dưới