Lý thuyết chung về axit nitric
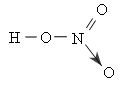
Lý thuyết về Lý thuyết chung về axit nitric
1. Tính chất vật lý
- Là chất lỏng không màu, bốc khói mạnh trong không khí ẩm ; tan vô hạn trong nước
- Axit nitric không bền, khi có ánh sáng , phân huỷ 1 phần : 4HNO3→4NO2+O2+2H2O4HNO3→4NO2+O2+2H2O
Do đó axit HNO3 cất giữ lâu ngày có màu vàng do NO2 phân huỷ tan vào axit.
II. Tính chất hoá học
1. Tính axit : Là axit mạnh , trong dung dịch phân li hoàn toàn ra các ion : HNO3→H++NO3HNO3→H++NO3
- Dung dịch axit HNO3HNO3 có đầy đủ tính chất của môt dung dịch axit: làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
2. Tính oxi hoá : HNO3HNO3 chứa nitơ có số oxi hóa cao nhất là +5 nên có tính oxi hóa mạnh
Tuỳ vào nồng độ của axit và bản chất của chất khử mà HNO3HNO3 có thể bị khử đến NO,NO2,N2O,N2,NH4NO3NO,NO2,N2O,N2,NH4NO3 .
a. Với kim loại : HNO3HNO3 oxi hoá hầu hết các kim loại (trừ Au và Pt ) đến mức oxi hóa cao nhất , tạo thành muối nitrat và sản phẩm khử.
- Với những kim loại có tính khử yếu như : Cu, Ag…thì HNO3HNO3 đặc bị khử đến NO2;HNO3NO2;HNO3 loãng bị khử đến NO.
- Với những kim loại có tính khử mạnh hơn như : Mg, Zn, Al….thì HNO3HNO3 đặc bị khử yếu đến NO2;HNO3NO2;HNO3 loãng có thể bị kim loại khử mạnh như Mg, Al, Zn…khử đến N2O,N2N2O,N2 hoặc NH4NO3NH4NO3 .
Cu+4HNO3Cu+4HNO3 đặc →→ Cu(NO3)2+2NO2+2H2OCu(NO3)2+2NO2+2H2O
3Cu+8HNO33Cu+8HNO3 loãng →→ 3Cu(NO3)2+2NO+4H23Cu(NO3)2+2NO+4H2
● Lưu ý : Fe, Al, Cr bị thụ động hoá trong dung dịch HNO3 đặc nguội vì vậy khi cho các kim loại này tác dụng với HNO3 thì không xảy ra phản ứng.
b. Với phi kim
Khi đun nóng HNO3HNO3 đặc có thể tác dụng được với C, P, S…Ví dụ C+4HNO3()C+4HNO3() to→to→ CO2+4NO2+2H2OCO2+4NO2+2H2O
S+6HNO3()S+6HNO3() to→to→ H2SO4+6NO2+2H2OH2SO4+6NO2+2H2O
c. Với hợp chất
- H2S,HI,SO2,FeOH2S,HI,SO2,FeO , muối sắt (II)… có thể tác dụng với HNO3HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn. Ví dụ :
3FeO+10HNO3()3FeO+10HNO3() ® 3Fe(NO3)3+NO+5H2O3Fe(NO3)3+NO+5H2O
III. Điều chế
1. Trong phòng thí nghiệm
NaNO3(r)+H2SO4()NaNO3(r)+H2SO4() to→to→ HNO3+NaHSO4HNO3+NaHSO4
Hơi HNO3HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó.
2. Trong công nghiệp
- Được sản xuất từ amoniac theo sơ đồ :
NH3 +O2(to,Pt)→+O2(to,Pt)−−−−−−−→ NO +O2,to→+O2,to−−−−→ NO2 +O2,H2O→+O2,H2O−−−−−−−→ HNO3
Bài tập tự luyện có đáp án
Câu 1: Tính chất vật lý nào sau đây đúng với axit nitric ( HNO3HNO3 ) tinh khiết?
- A
- B
- C
- D
Axit nitric tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm, tan tốt trong nước.
Câu 2: Kim loại có tính khử mạnh như Mg,Al,Zn,...Mg,Al,Zn,... khi tác dụng với HNO3HNO3 loãng có thể tạo sản phẩm khử là:
- A
- B
- C
- D
HNO3HNO3 loãng nên không thể tạo sản phẩm khử là NO2NO2 → loại A,C,D.
Câu 3: Ứng dụng của hiện tượng thụ động hóa là:
- A
- B
- C
- D
Vì nhôm và sắt bị thụ động hóa trong HNO3HNO3 đặc nguội nên ứng dụng làm bình chứa bằng nhôm, sắt để dựng HNO3HNO3 đặc, nguội
Câu 4: Phản ứng điều chế axit nitric trong phòng thí nghiệm là
- A
- B
- C
- D
Để điều chế lượng nhỏ axit nitric trong phòng thí nghiệm, người ta đun hỗn hợp natri nitrat hoặc kali nitrat khan với axit sunfuric đặc.
Câu 5: Nồng độ axit nitric thu được trong quá trình điều chế công nghiệp thường có nồng độ:
- A
- B
- C
- D
Nồng độ thu được thường là 52-68%
Câu 6: Kết luận nào sau đây không đúng?
- A
- B
- C
- D
Axit nitric là một trong các axit mạnh nhất.
Câu 7: Cho kim loại Cu tác dụng với dung dịch HNO3HNO3 đặc, nóng thu được khí X. Khí X là
- A
- B
- C
- D
Phương trình: Cu+4HNO3to→Cu(NO3)2+2NO2↑+2H2OCu+4HNO3to→Cu(NO3)2+2NO2↑+2H2O
\Rightarrow X là NO2NO2
Câu 8: Phản ứng oxi hóa amoniac bằng oxi không khí thành nitơ monooxit là phản ứng:
- A
- B
- C
- D
Phản ứng oxi hóa amoniac bằng oxi không khí thành nitơ monooxit là phản ứng tỏa nhiệt, có ΔH<0ΔH<0
Câu 9: Chọn sơ đồ đúng dùng để điều chế HNO3HNO3 trong công nghiệp:
- A
- B
- C
- D
Sơ đồ điều chế HNO3HNO3 trong công nghiệp: N2→NH3→NO→NO2→HNO3N2→NH3→NO→NO2→HNO3
Câu 10: Giai đoạn không có trong quá trình sản xuất axit nitric trong công nghiệp là:
- A
- B
- C
- D
Phản ứng điều chế axit nitric trong công nghiệp gồm 3 giai đoạn trong đó giai đoạn oxi hóa amoniac bằng oxi không khí thì phương trình phải là: 4NH3+5O2Pt,to→4NO+6H2O4NH3+5O2Pt,to−−−→4NO+6H2O
Câu 11: Số liên kết cộng hóa trị của nitơ trong phân tử axit nitric là:
- A
- B
- C
- D
Gồm 4 liên kết cộng hóa trị giữa nitơ và oxi, trong đó có một liên kết cho nhận.

Câu 12: Axit nitric kém bền, bị phân hủy ngay nhiệt độ thường khi có ánh sáng, phương trình phân hủy nào sau đây đúng?
- A
- B
- C
- D
Phương trình phân hủy: 4HNO3to→4NO2+1O2+2H2O4HNO3to→4NO2+1O2+2H2O
Câu 13: Để điều chế axit nitric trong phòng thí nghiệm, ta có thể thay muối natri nitrat bằng muối nào sau đây:
- A
- B
- C
- D
Để điều chế axit nitric trong phòng thí nghiệm, người ta đun hỗn hợp natri nitrat hoặc kali nitrat rắn với axit sunfuric đặc.
Câu 14: Phản ứng giữa các kim loại với HNO3HNO3 có đặc điểm nào sau đây:
- A
- B
- C
- D
Kim loại đều bị oxi hóa đến mức oxi hóa cao nhất và tạo ra muối nitrat.
Câu 15: Giai đoạn thứ hai của quá trình điều chế axit nitric trong công nghiệp (đi từ N2)N2) xảy ra phương trình nào sau đây?
- A
- B
- C
- D
Các giai đoạn trong quá trình điều chế axit nitric trong công nghiệp là :
N2+to,xt,p→NH3+O2→NO+O2→NO2+O2+H2O→HNO3N2+to,xt,p−−−−→NH3+O2−−→NO+O2−−→NO2+O2+H2O−−−−−−→HNO3
Câu 16: Giai đoạn oxi hóa amoniac bằng oxi không khí thành nitơ monioxit (NO)(NO) trong quá trình điều chế axit nitric trong công nghiệp, dùng xúc tác là gì?
- A
- B
- C
- D
Xúc tác dùng trong quá trình trên là kim loại Pt.
Câu 17: Axit nitric thể hiện tính axit khi phản ứng với các chất:
- A
- B
- C
- D
Axit nitric thể hiện tính axit khi phản ứng với bazơ, oxit bazơ và muối của axit yếu hơn.
Câu 18: Những ứng dụng của axit nitric là:
(1) Sản xuất phân đạm.
(2) Làm nhiên liệu tên lửa.
(3) Sản xuất thuốc nổ.
(4) Nhiên liệu trong các thiết bị làm lạnh.
(5) Sản xuất thuốc nhuộm, dược phẩm.
- A
- B
- C
- D
(1), (3), (5) đúng
(2),(4) sai, vì đây là ứng dụng của hiđrazin và amoniac.
Câu 19: Axit nitric không oxi hóa được kim loại nào sau đây?
- A
- B
- C
- D
Pt và Au là hai kim loại có tính khử rất yếu →không có phản ứng với axit nitric.
Câu 20: Cho các phát biểu sau:
(1)Sản phẩm khử của nitơ trong phản ứng oxi hóa của HNO3 phụ thuộc vào nồng độ axit, độ mạnh yếu của chất khử và nhiệt độ phản ứng.
(2) Axit nitric có thể phản ứng với hầu hết các kim loại trừ Ag,Au.
(3) Các kim loại khi phản ứng với HNO3 đều bị oxi hóa đến mức oxi hóa cao nhất và tạo ra muối nitrat.
(4) Kim loại có tính khử mạnh như Mg,Al,Zn,... khi tác dụng với HNO3 đặc có thể tạo sản phẩm khử N2O,N2,NH4NO3.
(5) Al, Fe, Cr bị thụ động hóa trong HNO3 đặc nguội.
(6) HNO3 có thể oxi hóa được các phi kim như C,S,P,...
Số phát biểu đúng là:
- A
- B
- C
- D
Các phát biểu đúng là: (1),(3),(5),(6)
(2) sai, trừ Au,Pt .
(4) sai, phải là HNO3 loãng.
Câu 21: Al và Fe bị thụ động hóa trong HNO3 đặc, nguội là do:
- A
- B
- C
- D
Al và Fe bị thụ động hóa trong HNO3 đặc, nguội là do có lớp màng oxit bền bảo vệ.
Câu 22: Nước cường thủy (hay nước cường toan) có tính oxi hóa mạnh, có thể hoàn tan những kim loại có tính khử rất yếu như Au,Pt , nước cường thủy là hỗn hợp gồm:
- A
- B
- C
- D
nước cường thủy là hỗn hợp gồm HNO3,HCl với tỉ lệ thể tích tương ứng là 1:3
Câu 23: Trong công nghiệp axit nitric được điều chế từ chất đầu là:
- A
- B
- C
- D
Trong công nghiệp axit nitric được điều chế từ amoniac.
Câu 24: Tính chất hóa học đặc trưng của axit nitric là:
- A
- B
- C
- D
Tính chất hóa học đặc trưng của axit nitric là tính oxi hóa và tính axit.
Câu 25: Trong hợp chất HNO3 , nitơ có số oxi hóa là:
- A
- B
- C
- D
Trong hợp chất HNO3 , nitơ có số oxi hóa cao nhất là +5.
Câu 26: Cho các phát biểu sau: (1) Khi đun nóng, HNO3 có thể oxi hóa được các phi kim như C,S,P,...
(2) HNO3 là một trong các axit mạnh nhất.
(3) HNO3 là một chất điện ly yếu.
(4) HNO3 đặc có thể oxi hóa được nhiều hợp chất vô cơ và hữu cơ.
(5) Vải, giấy, mùn cưa,… bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
Số phát biểu đúng là:
(1) Khi đun nóng, HNO3 có thể oxi hóa được các phi kim như C,S,P,...
(2) HNO3 là một trong các axit mạnh nhất.
(3) HNO3 là một chất điện ly yếu.
(4) HNO3 đặc có thể oxi hóa được nhiều hợp chất vô cơ và hữu cơ.
(5) Vải, giấy, mùn cưa,… bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
Số phát biểu đúng là:
- A
- B
- C
- D
Phát biểu đúng là (1),(2),(4),(5).
(3) sai vì HNO3 là chất điện li mạnh