Dạng bài về tính bazơ yếu của amoniac

Lý thuyết về Dạng bài về tính bazơ yếu của amoniac
1. Tính bazơ yếu
a. Tác dụng với nước
NH3+H2O ⇄ NH4++OH−
- Thành phần dung dịch amoniac gồm: NH3,NH4+,OH−,H2O
- Dung dịch NH3 là một dung dịch bazơ yếu làm quỳ tím hóa xanh.
b. Tác dụng với dung dịch muối tạo thành kết tủa hiđroxit
AlCl3+3NH3+3H2O → Al(OH)3↓+3NH4Cl
Al3++3NH3+3H2O → Al(OH)3↓+3NH4+
c. Tác dụng với axit tạo muối amoni
NH3+HCl→NH4Cl (amoni clorua)
Hiện tượng: khi cho khí NH3 tác dụng với khí HCl là tạo ra khói trắng: NH4Cl 2NH3+H2SO4→(NH4)2SO4(amonisunfat)
2. Khả năng tạo phức của dung dịch NH3
Dung dịch NH3 có khả năng hòa tan hiđroxit, oxit hay muối ít tan của 1 số kim loại, tạo thành dung dịch phức chất như: Zn(OH)2; Cu(OH)2; AgCl ; Ni(OH)2; Ag2O
AgCl+2NH3→[Ag(NH3)2]Cl
Cu(OH)2+4NH3→[Cu(NH3)4](OH)2 (màu xanh thẫm)
Chú ý: nếu cho NH3 đến dư vào dung dịch Cu2+, hiện tượng quan sát được sẽ là: ban đầu có kết tủa màu xanh sau đó kết tủa tan dần tạo dung dịch màu xanh thẫm
Bài tập tự luyện có đáp án
Câu 1: Amoniac là một:
- A
- B
- C
- D
Amoniac là một bazơ yếu
NH3+H+→NH+4
Câu 2: Dung dịch amoniac thể hiện tính bazơ khi phản ứng với chất nào sau đây?
- A
- B
- C
- D
Dung dịch amoniac thể hiện tính bazơ khi phản ứng với axit, muối, chất chỉ thị.
→ amoniac thể hiện tính bazơ khi tác dụng với axit HCl
Câu 3: Dãy gồm các chất đều bị hoà tan trong dung dịch NH3 là:
- A
- B
- C
- D
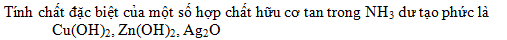
Câu 4: Dung dịch amoniac làm quỳ tím chuyển sang màu:
- A
- B
- C
- D
Dung dịch amoniac có tính bazơ nên làm quỳ tím chuyển sang màu xanh
Câu 5: Khi đặt hai bình mở nút đựng dung dịch HCl đặc và NH3 đặc gần nhau thì thấy có "khói" màu trắng tạo thành. Phương trình hóa học của phản ứng trên là:
- A
- B
- C
- D
HCl đặc phản ứng với NH3 đặc theo phương trình phản ứng:
HCl+NH3→NH4Cl
Khói trắng là NH4Cl
Câu 6: Hiện tượng khi nhỏ vài giọt dung dịch phenolphtalein vào dung dịch NH3 là:
- A
- B
- C
- D
Dung dịch NH3 có tính bazơ nên làm đổi màu dung dịch phenolphtalein sang màu hồng.
Câu 7: Phương trình ion thu gọn của phản ứng 2NH3+H2SO4→(NH4)2SO4 là:
- A
- B
- C
- D
Phương trình ion: 2NH3+2H++SO2−4→2NH+4+SO2−4
Phương trình ion thu gọn: NH3+H+→NH+4
Câu 8: Khi nhỏ từ từ dung dịch NH3 đến dư vào dung dịch muối đồng sunfat, sau phản ứng ta thấy:
- A
- B
- C
- D
2NH3+2H2O+CuSO4→Cu(OH)2+(NH4)2SO4
Cu(OH)2+4NH3→Cu(NH3)4(OH)2
Phức Cu(NH3)4(OH)2 có màu xanh đậm
Câu 9: Nhỏ phenolphtalein vào dung dịch nào sau đây thu được dung dịch màu hồng?
- A
- B
- C
- D
Vì dung dịch amoniac là một bazơ yếu nên có phản ứng màu với dung dịch phenolphtalein, làm dung dịch phenolphtalein chuyển sang màu hồng.