Trong một bình kín chứa 10 lít nitơ và 10 lít Hidro ở nhiệt độ $\Large

MỤC LỤC
Câu hỏi:
Trong một bình kín chứa 10 lít nitơ và 10 lít Hidro ở nhiệt độ $\Large 0^{\circ} \mathrm{C}$ và 10 atm. Sau phản ứng tổng hợp $\Large\mathrm{NH}_{3}$, lại đưa bình về $\Large 0^{\circ} \mathrm{C} .$ Biết rằng có 60 % hidro tham gia phản ứng, áp suất trong bình sau phản ứng là :
Đáp án án đúng là: B
Lời giải chi tiết:
$\Large\mathrm{N_{2} + 3 H_{2} \leftrightharpoons 2 NH_{3}}$
Theo phương trình phản ứng tổng hợp $\Large\mathrm{NH_3}$ ta thấy $\Large\mathrm{N_2}$ và $\Large\mathrm{H_2}$ phản ứng theo tỉ lệ là $\Large\mathrm{\dfrac{n_{H_2}}{n_{N_2}}=\dfrac{3}{1}}$
Theo đề bài ta thấy $\Large\mathrm{\dfrac{n_{H_2}}{n_{N_2}}=\dfrac{V_{H_2}}{V_{N_2}}=\dfrac{1}{1}}$. Vậy $\Large\mathrm{H_2}$ thiếu nên hiệu suất phản ứng tính theo $\Large\mathrm{H_2}$.
$\Large\mathrm{V_{H_{2 \ phản \ ứng}} =10.60\% = 6 \ lít}$
$\Large\Rightarrow \mathrm{V_{N_{2 \ phản \ ứng}} = 2 \ lít}$
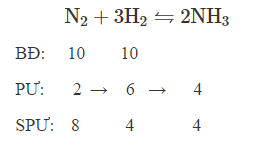
$\Large\Rightarrow \mathrm{V_{N_{2 \ sau}} = 8 + 4 + 4 = 16}$
Vì trước và sau phản ứng nhiệt độ không thay đổi nên:
$\Large\mathrm{\dfrac{V_{1}}{V_{2}}=\dfrac{n_{1}}{n_{2}}=\dfrac{P_{1}}{P_{2}}=\dfrac{20}{16}}$
$\Large\Rightarrow \mathrm{P_2=8 \ atm}$.
Xem thêm các bài tiếp theo bên dưới
- Nếu toàn bộ quá trình điều chế $\Large\mathrm{HNO_3}$ có hiệu suất 80%
- Phân đạm urê thường chỉ chứa 46% N. Khối lượng phân urê đủ cung cấp 70
- Cho 86 gam hỗn hợp X gồm x mol $\Large\mathrm{Fe}_{3} \mathrm{O}_{4}$,
- Điện phân dung dịch $\Large\mathrm{AgNO_3}$ với điện cực trơ một thời
- Cho a mol hỗn hợp rắn X chứa $\large\mathrm{Fe_3O_4, FeCO_3, Al}$ (tro