Lý thuyết chung về axit
Lý thuyết về Lý thuyết chung về axit
Axit cacboxylic
I. ĐỊNH NGHĨA, PHÂN LOẠI, DANH PHÁP
1. Định nghĩa
Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
2. Phân loại
· Nếu nhóm cacboxyl liên kết trực tiếp với nguyên tử hiđro hoặc gốc ankyl thì tạo thành dãy axit no, mạch hở, đơn chức, công thức chung là \[{{C}_{n}}{{H}_{2n+1}}COOH\] , gọi là dãy đồng đẳng của axit fomic (\[HCOOH\] ).
· Nếu gốc hiđrocacbon trong phân tử axit có chứa liên kết đôi, liên kết ba thì gọi là axit không no, ví dụ \[C{{H}_{2}}=CH-COOH,CH{}^\text{o}C-COOH\] ,...
· Nếu gốc hiđrocacbon là vòng thơm thì gọi là axit thơm, ví dụ \[{{C}_{6}}{{H}_{5}}-COOH\] (axit benzoic),...
· Nếu trong phân tử có nhiều nhóm cacboxyl (-COOH) thì gọi là axit đa chức, ví dụ : \[HOOC-COOH\] (axit oxalic), \[HOOCC{{H}_{2}}COOH\] (axit malonic),...
3. Danh pháp
· Theo IUPAC, tên của axit cacboxylic mạch hở chứa không quá 2 nhóm cacboxyl được cấu tạo bằng cách đặt từ axit trước tên của hiđrocacbon tương ứng. Theo mạch chính (mạch chính bắt đầu từ nguyên tử C của nhóm –COOH) rồi thêm vào đó đuôi oic.
Tên một số axit thường gặp
|
Công thức |
Tên thông thường |
Tên thay thế |
|
\[H-COOH\] |
Axit fomic |
Axit metanoic |
|
\[C{{H}_{3}}-COOH\] |
Axit axetic |
Axit ethanoic |
|
\[C{{H}_{3}}C{{H}_{2}}-COOH\] |
Axit propionic |
Axit propanoic |
| ${(C{H_3})_2}CH - COOH$ |
Axit isobutiric |
Axit 2-metylpropanoic |
|
\[C{{H}_{3}}{{\left( C{{H}_{2}} \right)}_{3}}-COOH\] |
Axit valeric |
Axit pentanoic |
|
$C{H_2} = CH - COOH$ |
Axit acrylic |
Axit propenoic |
|
\[C{{H}_{2}}=C\left( C{{H}_{3}} \right)-COOH\] |
Axit metacrylic |
Axit 2-metylpropenoic |
|
\[HOOC-COOH\] |
Axit oxalic |
Axit etanđioic |
|
\[{{C}_{6}}{{H}_{5}}-COOH\] |
Axit benzoic |
Axit benzoic |
II. TÍNH CHẤT VẬT LÍ
Ở điều kiện thường, tất cả các axit cacboxylic đều là những chất lỏng hoặc rắn. Điểm sôi của các axit cacboxylic cao hơn của anđehit, xeton và cả ancol có cùng số nguyên tử cacbon. Do nhóm cacboxyl tạo thành liên kết hiđro liên phân tử ở axit cacboxylic.
Axit cacboxylic cũng tạo liên kết hiđro với nước và nhiều chất khác. Các axit fomic, axetic, propionic tan vô hạn trong nước. Khi số nguyên tử C tăng lên thì độ tan trong nước giảm.
III.TÍNH CHẤT HOÁ HỌC
1. Tính axit
Axit cacboxylic là những axit yếu. Tuy vậy, chúng có đầy đủ tính chất của một axit như : làm hồng quỳ tím, tác dụng với kim loại giải phóng hiđro, phản ứng với bazơ, đẩy được axit yếu hơn ra khỏi muối.
$RCOOH+NaOH\to RCOONa+{{H}_{2}}O$
$2RCOOH+N{{a}_{2}}C{{O}_{3}}\to 2RCOONa+{{H}_{2}}O+C{{O}_{2}}$
$2RCOOH+Zn\to {{(RCOO)}_{2}}Zn+{{H}_{2}}$
$2RCOOH+CuO\to {{(RCOO)}_{2}}Cu+{{H}_{2}}O$
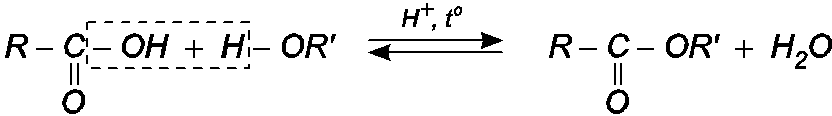
2. Phản ứng thế nhóm OH
· Phản ứng của axit axetic với etanol xúc tác axit là phản ứng thuận nghịch
$C{{H}_{3}}-COOH$ + \[{{C}_{2}}{{H}_{5}}-O-H\] $\overset {{H^ + },{t^o}} \leftrightarrows $$C{{H}_{3}}COO{{C}_{2}}{{H}_{5}}$ + $ {{H}_{2}}O$
etyl axetat
Một cách tổng quát, phản ứng giữa axit cacboxylic và ancol được viết như sau :
Kết luận : Phản ứng exte hóa là phản ứng thuận nghich : Chiều thuận là phản ứng este hoá, chiều nghịch là phản ứng thuỷ phân este.
IV. ĐIỀU CHẾ
1. Lên men giấm là phương pháp cổ nhất, ngày nay chỉ còn dùng để sản xuất giấm ăn :
\[C{{H}_{3}}C{{H}_{2}}OH+{{O}_{2}}\] $\xrightarrow[25-{{30}^{o}}C]{\text{Men gi }\!\!\hat{\mathrm{E}}\!\!\text{ m}}$\[C{{H}_{3}}COOH+{{H}_{2}}\]
2. Oxi hoá anđehit axetic trước đây là phương pháp chủ yếu sản xuất axit axetic :
\[C{{H}_{3}}CH=\ O\ \ +\ \ \frac{1}{2}{{O}_{2}}\]$\xrightarrow[{}]{xt,\ {{t}^{o}}}\ \ \ C{{H}_{3}}COOH\ \ $
3. Đi từ metanol và cacbon oxit, nhờ xúc tác thích hợp là phương pháp hiện đại sản xuất axit axetic :
\[C{{H}_{3}}OH+CO\] $\xrightarrow{xt,\,\,\,\,{{t}^{o}}}$ \[C{{H}_{3}}COOH\]
4. Oxi hóa ankan
- Oxi hóa butan thu được axit axetic:
\[2C{{H}_{3}}C{{H}_{2}}C{{H}_{2}}C{{H}_{3}}+5{{O}_{2}}\xrightarrow[{{180}^{o}}C,50atm]{xt}4C{{H}_{3}}COOH+2{{H}_{2}}O\]
- Oxi hóa không hoàn toàn các ankan có mạch C dài để thu được các axit có phân tử khối lớn:
$2R-C{{H}_{2}}-C{{H}_{2}}-{{R}^{1}}+5{{O}_{2}}\xrightarrow{{{t}^{o}},xt}2R-COOH+2{{R}^{1}}-COOH+2{{H}_{2}}O$
Bài tập tự luyện có đáp án
Câu 1: Để điều chế axit trực tiếp từ anđehit ta có thể dùng chất oxi hóa nào sau đây?
- A
- B
- C
- D
Dùng dung dịch $ AgN{ O _ 3 }/N{ H _ 3 } $ hoặc $ Cu{{\left( OH \right)}_ 2 }/O{ H ^ - },{ t ^ o }. $ đều thu được muối của axit chứ không thu được axit
Câu 2: Hợp chất $ C{ H _ 3 }C{ H _ 2 }\left( C{ H _ 3 } \right)C{ H _ 2 }C{ H _ 2 }CH\left( { C _ 2 }{ H _ 5 } \right)COOH $ có tên quốc tế là
- A
- B
- C
- D
$ \overset 6 {\mathop C }\,{ H _ 3 }\overset 5 {\mathop C }\,{ H _ 2 }\left( C{ H _ 3 } \right)\overset 4 {\mathop C }\,{ H _ 2 }\overset 3 {\mathop C }\,{ H _ 2 }\overset 2 {\mathop C }\,H\left( { C _ 2 }{ H _ 5 } \right)\overset 1 {\mathop C }\,OOH $ : axit 2 – etyl – 5 - metylhexanoic
Câu 3: Axit nào dưới đây là axit không no, đơn chức, mạch hở ?
- A
- B
- C
- D
Asxit không no, đơn chức, mạch hở là $ { C _ 4 }{ H _ 6 }{ O _ 2 } $
Câu 4: Hợp chất X có công thức phân tử $ { C _ 4 }{ H _ 6 }{ O _ 2 } $ . X tác dụng được với dung dịch bazơ và với natri. X thuộc loại hợp chất nào sau đây?
natri. X thuộc loại hợp chất nào sau đây?
- A
- B
- C
- D
X tác dụng được với bazơ và Na nên X có nhóm COOH, X có CTPT là $ { C _ 4 }{ H _ 6 }{ O _ 2 } $ nên X là axit đơn chức.
Câu 5: Độ dài liên kết đơn C O trong axit cacboxylic $ \left( RCOOH \right) $
- A
- B
- C
- D
Axit có dạng $ R-\underset O {\mathop{\underset{|\,|}{\mathop C }\,}}\,-O-H $ , ancol có dạng $ R-C{ H _ 2 }-O-H $
Axit có nhóm C=O hút e còn ancol thì không nên làm độ dài liên kết đơn C – O của axit ngắn hơn so với ancol
Câu 6: Phản ứng nào sau đây không thể hiện tính axit của axit axetic ?
- A
- B
- C
- D
Phản ứng không thể hiện tính axit của axit axetic là $ 2C{ H _ 3 }\text{COOH}\xrightarrow{{ P _ 2 }{ O _ 5 }}{{(C{ H _ 3 }CO)}_ 2 }O+{ H _ 2 }O $
Câu 7: Axit butanoic là sản phẩm của phản ứng oxi hoá không hoàn toàn
- A
- B
- C
- D
$ { C _ 3 }{ H _ 7 }CHO\,+\, \!\![\!\! O]\to { C _ 3 }{ H _ 7 }\text{COOH}\,\text{(butanoic)} $
Câu 8: Dung dịch axit acrylic $ \left( C{ H _ 2 }=CH-COOH \right) $ không phản ứng được với chất nào sau đây?
- A
- B
- C
- D
$ \left( C{ H _ 2 }=CH-COOH \right) $ không phản ứng với $ Mg{{\left( N{ O _ 3 } \right)}_ 2 } $
Câu 9: Công thức chung của axit cacboxylic không no, một liên kết đôi, đơn chức là
- A
- B
- C
- D
Công thức chung của axit cacboxylic không no, một liên kết đôi, đơn chức là $ { C _ n }{ H _{2n2}}{ O _ 2 }\,(n\ge 2) $
Câu 10: Phát biểu nào sau đây không đúng khi nói về axit cacboxylic ? Khi tăng mạch cacbon thì
Khi tăng mạch cacbon thì
- A
- B
- C
- D
Phát biếu không đúng là : "Khi tăng mạch C thì tính axit tăng" do tính axit tăng hay giảm phụ thuộc vào nhóm hiđrocacbon đính với gốc COOH có khả năng hút e hay đẩy e. Với axit no, tăng mạch C làm tăng khả năng đẩy e của gốc HC thì làm tính axit giảm
Câu 11: Trong công nghiệp, phương pháp hiện đại nhất được dùng để điều chế axit axetic là
- A
- B
- C
- D
phương pháp hiện đại nhất được dùng để điều chế axit axetic là đi từ metanol
$ C{ H _ 3 }OH + CO \to C{ H _ 3 }COOH~ $
Câu 12: Đốt cháy hoàn toàn hỗn hợp X gồm 2 axit cacboxylic được mol $ C{ O _ 2 } $ = mol $ { H _ 2 }O $ . X gồm
- A
- B
- C
- D
$ { n _{C{ O _ 2 }}}={ n _{{ H _ 2 }O}} $ $ \to $ 2 axit đều có 1 liên kết pi trong phân tử nên X gồm 2 axit no, đơn chức, mạch hở
Câu 13: Công thức phân tử của axit fomic là
- A
- B
- C
- D
Axit fomic $ HCOOH\to C{{H}_{2}}{{O}_{2}} $
Câu 14: Tráng gương hoàn toàn hợp chất hữu cơ X bằng $ AgN{ O _ 3 }/N{ H _ 3 } $ thu được hỗn hợp sản phẩm chỉ gồm các chất vô cơ. X có cấu tạo
- A
- B
- C
- D
X có thể là : $ HCHO, $ $ HCOON{ H _ 4 } $ , $ HCOOH. $
$ HCHO+4AgN{ O _ 3 }+6N{ H _ 3 }+2{ H _ 2 }O\to {{(N{ H _ 4 })}_ 2 }C{ O _ 3 }+4N{ H _ 4 }N{ O _ 3 }+4Ag $
$ HC\text{OOH}+2AgN{ O _ 3 }+4N{ H _ 3 }+{ H _ 2 }O\to {{(N{ H _ 4 })}_ 2 }C{ O _ 3 }+2N{ H _ 4 }N{ O _ 3 }+2Ag $
$ HC\text{OON}{{ H }_ 4 }+2AgN{ O _ 3 }+3N{ H _ 3 }+{ H _ 2 }O\to {{(N{ H _ 4 })}_ 2 }C{ O _ 3 }+2N{ H _ 4 }N{ O _ 3 }+2Ag $
Câu 15: Chất nào sau đây là axit metacrylic ?
- A
- B
- C
- D
$ C{ H _ 2 }=C(C{ H _ 3 })COOH $ : axit metacrylic
Câu 16: Cho axit X có CTCT : $ C{ H _ 3 }-CH(C{ H _ 3 })-C{ H _ 2 }-C{ H _ 2 }-C\text{OOH} $ . Tên của X là
- A
- B
- C
- D
$ \overset 5 {\mathop C }\,{ H _ 3 }-\overset 4 {\mathop C }\,H(C{ H _ 3 })-\overset 3 {\mathop C }\,{ H _ 2 }-\overset 2 {\mathop C }\,{ H _ 2 }-\overset 1 {\mathop C }\,\text{OOH} $ : axit 4-metylpentanoic.
Cách gọi: Axit + số chỉ vị trí nhánh + tên nhánh + tên hiđrocacbon no tương ứng mạch chính + oic
Câu 17: Công thức nào dưới đây là công thức cấu tạo của axit 2,4-đimetylpentanoic?
- A
- B
- C
- D
2,4-đimetylpentanoic: $ \overset 5 {\mathop C }\,{ H _ 3 }-\overset 4 {\mathop C }\,H(C{ H _ 3 })-\overset 3 {\mathop C }\,{ H _ 2 }-\overset 2 {\mathop C }\,H(C{ H _ 3 })-\overset 1 {\mathop C }\,\text{OOH} $
Cách gọi :Axit + số chỉ vị trí nhánh + tên nhánh + tên hiđrocacbon no tương ứng mạch chính + oic
Câu 18: Giấm ăn là dung dịch axit axetic có nồng độ là
- A
- B
- C
- D
Giấm ăn là dung dịch axit $ C{ H _ 3 }\text{COOH} $ có nồng độ 2% →5%
Câu 19: Axit 2-metylpropanoic có công thức cấu tạo là
- A
- B
- C
- D
$ \overset 3 {\mathop C }\,{ H _ 3 }-\overset 2 {\mathop C }\,H(C{ H _ 3 })-\overset 1 {\mathop C }\,\text{OOH} $ : 2-metylpropanoic
Câu 20: Phương trình hóa học nào sau đây không đúng ?
- A
- B
- C
- D
Phương trình không đúng là :
$ {{\left( C{ H _ 3 }COO \right)}_ 2 }Ca +\text{ C}{{ O }_ 2 }+{ H _ 2 }O\to CaC{ O _ 3 }+~2C{ H _ 3 }COOH~ $ do $ C{ O _ 2 }\,+\,{ H _ 2 }O $ là axit yếu, yếu hơn axit $ C{ H _ 3 }COOH~ $ nên chỉ có phản ứng ngược lại.
Câu 21: Axit axetic tác dụng được với dung dịch nào ?
- A
- B
- C
- D
Axit axetic tác dụng được với natri hiđroxit, amoni cacbonat và natri phenolat
$ C{ H _ 3 }\text{COOH}\, + \,\text{NaOH}\,\to C {{ H }_ 3 }\text{COONa}\, + \,{{ H }_ 2 }O $
$ {{(N{ H _ 4 })}_ 2 }C{ O _ 3 }+2C{ H _ 3 }\text{COOH}\to 2 C {{ H }_ 3 }\text{COON}{{ H }_ 4 }+{ H _ 2 }O+C{ O _ 2 } $
$ { C _ 6 }{ H _ 5 }ONa+C{ H _ 3 }\text{COOH}\to {{ C }_ 6 }{ H _ 5 }OH+\,C{ H _ 3 }\text{COONa} $ $ $
Câu 22: Phản ứng nào sau đây đúng ?
- A
- B
- C
- D
Phương trình đúng là : $ HCOOH + Cu{{\left( OH \right)}_ 2 }\xrightarrow { }{{\left( HCOO \right)}_ 2 }Cu + { H _ 2 }O $
Câu 23: Cho các dung dịch sau đây : axit propionic, axit acrylic, phenol, nước, ancol etylic. Những chất nào làm quỳ đổi tím chuyển sang màu đỏ ?
- A
- B
- C
- D
Axit làm quỳ tím chuyển sang màu đỏ :axit propionic, axit acrylic
Câu 24: Chất tạo được kết tủa đỏ gạch khi đun nóng với $ Cu{{\left( OH \right)}_ 2 }/O{ H ^ - } $ là
- A
- B
- C
- D
Các chất tạo kết tủa đỏ gạch với $ Cu{{\left( OH \right)}_ 2 }/O{ H ^ - } $ khi trong phân tử có nhóm CHO
Đáp án là : $ HCHO, $ $ HOC{ H _ 2 }CHO, $ $ HCOOH $
Câu 25: Gọi tên hợp chất sau :
$ C{ H _ 2 }=CH-\underset{{ C _ 2 }{ H _ 5 }}{\mathop{\underset | {\mathop{C}}\,}}\,=CH-C\text{OOH} $
- A
- B
- C
- D
$ \overset 5 {\mathop C }\,{ H _ 2 }=\overset 4 {\mathop CH }\,-\underset{{ C _ 2 }{ H _ 5 }}{\mathop{\underset | {\mathop{\overset 3 {\mathop C }}}\,}}\,=\overset 2 {\mathop C }\,H-\overset 1 {\mathop C }\,\text{OOH} $
Câu 26: Axit X có công thức tổng quát là $ {{C}_{n}}{{H}_{2n2}}{{O}_{4}} $ thuộc loại axit nào sau đây:
- A
- B
- C
- D
X thuộc loại no, hở, 2 chức
Câu 27: Ứng dụng nào sau đây không phải của axit axetic
- A
- B
- C
- D
Axit axetic không dùng làm thuốc tẩy rửa
Câu 28: Trong các chất có công thức phân tử sau đây, chất nào có thể là axit?
- A
- B
- C
- D
Chất có thể là axit là $ { C _ 5 }{ H _{10}}{ O _ 2 } $ .
Câu 29: Cho hợp chất sau : $ HOOC{{(C{ H _ 2 })}_ 4 }COOH $ . Tên hợp chất theo danh pháp thông thường là :
- A
- B
- C
- D
$ HOOC{{(C{ H _ 2 })}_ 4 }COOH $ : Axit ađipic.
Câu 30: Axit acrylic không có phản ứng
- A
- B
- C
- D
Axit acrylic : $ C{ H _ 2 }=CH-C\text{OOH} $ $ \to $ X không phản ứng với $ BaC{ l _ 2 }. $
Câu 31: Axit nào sau đây không phải là axit béo ?
- A
- B
- C
- D
Axit béo là axit có số C chẵn, $ C\ge 16 $ . Nên axit không phải là axit béo là axit acrylic
$ C{ H _ 2 }=CH-COOH $
Câu 32: Axit fomic làm quỳ tím chuyển màu gì ?
- A
- B
- C
- D
Axit làm quỳ đổi màu đỏ
Câu 33: Phản ứng nào sau đây không đúng ?
- A
- B
- C
- D
$ { C _ 6 }{ H _ 5 }COONa + C{ O _ 2 }+ { H _ 2 }O\xrightarrow { }{ C _ 6 }{ H _ 5 }COOH + NaHC{ O _ 3 } $
Là phản ứng sai do axit $ { H _ 2 }C{ O _ 3 } $ yếu hơn axit $ { C _ 6 }{ H _ 5 }COOH $
Câu 34: Axit nào sau đây được dùng để điều chế xà phòng ?
- A
- B
- C
- D
Axit dùng để điều chế xà phòng là axit béo : axit panmitic $ ({ C _{15}}{ H _{31}}COOH) $
Câu 35: Có các phương trình hóa học sau : $ HCOOH + A{ g _ 2 }O\to C{ O _ 2 }+ 2Ag + { H _ 2 }O \left( 1 \right) $
$ 2HCOOH + Cu{{\left( OH \right)}_ 2 }\xrightarrow { }{{\left( HCOO \right)}_ 2 }Cu +\text{ 2}{ H _ 2 }O \left( 2 \right) $
$ HCOOH + 2Cu{{\left( OH \right)}_ 2 }\xrightarrow{O{ H ^ - },\,{ t ^ o }}C{ u _ 2 }O + 3{ H _ 2 }O + C{ O _ 2 }\left( 3 \right) $
$ HCOOH + CaC{ O _ 3 }\to {{\left( HCOO \right)}_ 2 }Ca + C{ O _ 2 }+ { H _ 2 }O \left( 4 \right) $
$ HCOOH + CH\equiv CH\to HCOOCH=C{ H _ 2 }\left( 5 \right) $
Phản ứng đúng là
$ HCOOH + A{ g _ 2 }O\to C{ O _ 2 }+ 2Ag + { H _ 2 }O \left( 1 \right) $
$ 2HCOOH + Cu{{\left( OH \right)}_ 2 }\xrightarrow { }{{\left( HCOO \right)}_ 2 }Cu +\text{ 2}{ H _ 2 }O \left( 2 \right) $
$ HCOOH + 2Cu{{\left( OH \right)}_ 2 }\xrightarrow{O{ H ^ - },\,{ t ^ o }}C{ u _ 2 }O + 3{ H _ 2 }O + C{ O _ 2 }\left( 3 \right) $
$ HCOOH + CaC{ O _ 3 }\to {{\left( HCOO \right)}_ 2 }Ca + C{ O _ 2 }+ { H _ 2 }O \left( 4 \right) $
$ HCOOH + CH\equiv CH\to HCOOCH=C{ H _ 2 }\left( 5 \right) $
Phản ứng đúng là
- A
- B
- C
- D
Cả 5 phản ứng đều đúng
Câu 36: Axit không no, đơn chức, mạch hở có một liên kết đôi trong gốc hiđrocacbon có công thức là
- A
- B
- C
- D
Công thức phù hợp là $ { C _ n }{ H _{2n-1}}COOH\,\,(n\ge 2). $
Câu 37: Một axit cacboxylic có công thức tổng quát là $ { C _ n }{ H _{2n+22am}}{{\left( COOH \right)}_ m } $ . Các giá trị n, a, m lần lượt được xác định là
- A
- B
- C
- D
$ { C _ n }{ H _{2n+22am}}{{\left( COOH \right)}_ m } $
m là số nhóm COOH $ \to m\ge 1 $
a là số liên kết $ \pi $ +v trong hiđrocabon nên $ a\ge 0 $
n $ \ge $ 0
Xem thêm các bài tiếp theo bên dưới