So sánh tính chất vật lý các nguyên tố trong bảng tuần hoàn
Lý thuyết về So sánh tính chất vật lý các nguyên tố trong bảng tuần hoàn
1/ Bán kính nguyên tử
- Trong một chu kì: đi từ trái sang phải, điện tích hạt nhân tăng dần nhưng số lớp electron của nguyên tử nguyên tố bằng nhau, do đó lực hút của hạt nhân với electron lớp ngoài cùng tăng lên làm bán kính giảm dần
- Trong một nhóm A: Bán kính nguyên tử tăng dần theo chiều từ trên xuống dưới
2/ Độ âm điện :
a/ Khái niệm
Độ âm điện của một nguyên tố đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
b/ Sự biến đổi độ âm điện các nguyên tố.
- Trong một chu kì, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân thì giá trị độ âm điện của các nguyên tử nói chung tăng dần.
- Trong một nhóm A, đi từ trên xuống theo chiều tăng dần của điện tích hạt nhân thì giá trị độ âm điện của các nguyên tử nói chung giảm dần.
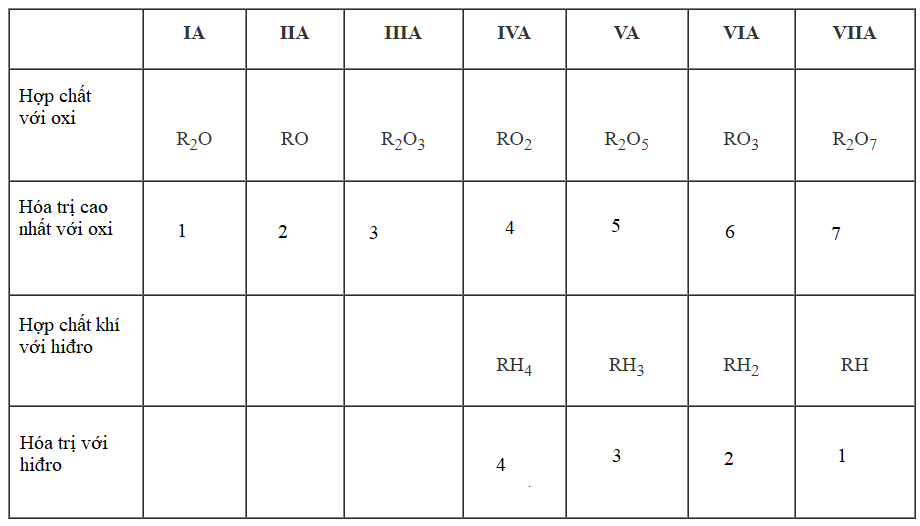
3/ Hóa trị của các nguyên tố
- Trong 1 chu kì: đi từ trái sang phải, hóa trị cao nhất với oxi của các nguyên tố tăng lần lượt từ 1 đến 7, hóa trị với hiđro của các phi kim giảm từ 4 đến 1.
Bài tập tự luyện có đáp án
Câu 1: Trong bảng tuần hoàn hóa học nhóm A có độ âm điện lớn nhất là:
- A
- B
- C
- D
Trong cùng 1 chu kì, độ âm điện các nguyên tố tăng dần từ trái sang phải và các nguyên tố nhóm halogen đứng cuối chu kì (không tính nhóm khí hiếm) $ \to $ Độ âm điện nhóm halogen là lớn nhất
Câu 2: Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
- A
- B
- C
- D
Li đến F là cùng một chu kì, theo chiền tăng dần điện tích hạt nhân thì bán kính giảm, độ âm điện tăng dần
Câu 3: Nguyên tố nào sau đây có năng lương ion hóa thứ nhấn ( $ {{I}_{1}} $ ) lớn nhất
- A
- B
- C
- D
Na, Al, Si cùng một chu kì, điện tích hạt nhân tăng dần $ \Rightarrow $ năng lượng ion hóa tăng dần Na < Al < Si
Na và K cùng nhóm chính, điện tích hạt nhân tăng $ \to $ năng lượng ion hóa giảm Na > K
Vậy Si có năng lượng ion hóa lớn nhất
Câu 4: Đại lượng đặc trưng cho khả năng hút electron của nguyên tử các nguyên tố khi hình thành liên kết hoá học là :
- A
- B
- C
- D
Đại lượng đặc trưng cho khả năng hút electron của nguyên tử các nguyên tố khi hình thành liên kết hoá học là độ âm điện
Câu 5: Nguyên tố nào sau đây có năng lượng ion hóa thứ nhất $ {{I}_{1}} $ nhỏ nhất
- A
- B
- C
- D
Be, B, C, N cùng thuộc một chu kì mà điện tích hạt nhân tăng dần $ \to $ năng lượng ion hóa thứ nhất $ {{I}_{1}} $ tăng dần $ \to $ Năng lượng ion hóa thứ nhất của $ _{4}Be $ nhỏ nhất