Dạng bài oxi tác dụng với dụng với chất oxi hóa
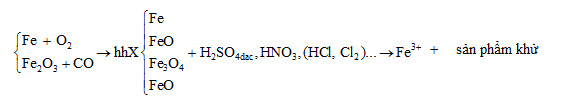
Lý thuyết về Dạng bài oxi tác dụng với dụng với chất oxi hóa
Dạng toán oxit kim loại tác dụng với chất oxi hóa
Chú ý: - Bài toán có thể đi từ hỗn hợp X. Chất oxi hóa có thể thay thế H2SO4 và HNO3 bằng một số chất oxi khác
- Bài toán có thể thêm một số phản ứng phụ khác như dung dịch muối tác dụng với bazơ..
- Hỗn hợp X có thể bớt số chất, một số kim loại khác
Phương pháp giải chung: Bài tập này có rất nhiều cách giải, dưới đây là 2 các giải chung phổ biển nhất.
- Cách giải 1:
- Quy đổi hỗn hợp X gồm Fe và O.
- Dùng phương pháp bảo toàn electron đối với :
Feo→Fe3+, O0→O−2, N+5→N+x, S+6→S+4,S0,S−2
- Dùng bảo toàn nguyên tố Fe, O, C
- Dùng bảo toàn khối lượng: mX=mFe+mO , mFe2O3+mCO=mX+mCO2
- Cách giải 2: dùng bảo toàn e của cả quá trình
- Đối với Fe+O2 dùng bảo bảo electron Fe0→Fe+3, O02→O−2 , spk
- Đối với Fe2O3+CO dùng bảo toàn C+2→C+4, spk
- Dùng bảo toàn nguyên tố Fe, O, C
- Dùng bảo toàn khối lượng: mX=mFe+mO , mFe2O3+mCO=mX+mCO2
Bài tập tự luyện có đáp án
Câu 1: Cho các chất: Fe2O3,FeCO3,FeCl2,Fe(OH)3 lần lượt tác dụng với dung dịch HNO3 loãng. Số phản ứng oxi hóa – khử là
- A
- B
- C
- D
Phản ứng oxi hóa – khử xảy ra khi Fe trong hợp chất chưa đạt hóa trị cao nhất
⇒HNO3 có phản ứng oxi hóa khử với các chất FeCO3,FeCl2