ĐIỀU CHẾ KIM LOẠI I. Nguyên tắc điều chế kim loại Thực
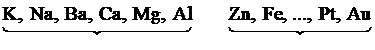
Lý thuyết về ĐIỀU CHẾ KIM LOẠI I. Nguyên tắc điều chế kim loại Thực
ĐIỀU CHẾ KIM LOẠI
I. Nguyên tắc điều chế kim loại
Thực hiện quá trình khử ion kim loại: ${{M}^{n+}}+ne\to M$
II. Phương pháp điều chế kim loại
|
Phương pháp thủy luyện |
Phương pháp nhiệt luyện |
Phương pháp điện phân |
|
- Điều chế những kim loại đứng sau Mg. - Cơ sở: dùng các kim loại mạnh hơn (như Mg, Al) để khử ion kim loại thành kim loại cần điều chế. Ví dụ: $Fe+CuS{{O}_{4}}$ $\to FeS{{O}_{4}}+\text{ }Cu~~$
|
- Điều chế những kim loại đứng sau Al. - Cơ sở: khử những ion kim loại trong các hợp chất ở nhiệt độ cao bằng các chất khử mạnh như C, CO, ${{H}_{2}}$hoặc kim loại Al, kim loại kiềm, kiềm thổ. Ví dụ: $F{{e}_{2}}{{O}_{3}}+3CO\xrightarrow{{{t}^{o}}}2Fe+3CO$ - Phản ứng nhiệt nhôm: dùng Al để khử các oxit của kim loại khó nóng chảy như Cr, Fe,… $C{{r}_{2}}{{O}_{3}}+2Al\xrightarrow{{{t}^{o}}}$$2Cr+A{{l}_{2}}{{O}_{3}}~$ - Với những kim loại kém hoạt động như Hg, Ag thì chỉ cần đốt cháy quặng. $HgS\text{ }+\text{ }{{O}_{2}}~\xrightarrow{{{t}^{o}}}Hg\text{ }+\text{ }S{{O}_{2}}$ |
- Điều chế hầu hết các kim loại. - Cơ sở: Với các kim loại từ Al trở về trước: điện phân nóng chảy muối, oxit hay bazơ của chúng. Ví dụ: $2A{{l}_{2}}{{O}_{3}}$ $\xrightarrow[N{{a}_{3}}Al{{F}_{6}}]{dpnc}$$2Al\text{ }+\text{ }3{{O}_{2}}$ - Với các kim loại đứng sau Al: điện phân dung dịch muối của chúng. Ví dụ: $2ZnS{{O}_{4}}+\text{ }2{{H}_{2}}O$$\xrightarrow{dpdd}$ $2Zn\text{ }+\text{ }{{O}_{2}}+\text{ }2{{H}_{2}}S{{O}_{4}}$ |
III. Lí thuyết trọng tâm về điện phân
- Trong quá trình điện phân, dưới tác dụng của điện trường các cation chạy về cực âm (catot) còn các anion chạy về điện cực dương (anot).
- Tại catot xảy ra quá trình khử cation (${{M}^{n+}}~+\text{ }ne\text{ }\to \text{ }M$) còn tại anot xảy ra quá trình oxi hóa anion (${{X}^{n-}}~\to X\text{ }+\text{ }ne$).
|
|
|
|
Điện phân nóng chảy |
điện phân dung dịch |
Các bước xác định quá trình điện phân
B1: Xác định các cation và anion ứng với mỗi điện cực (ion dương chuyển về cực (-) là catot, ion âm chuyển về cực (+) là anot ).
B2: Viết quá trình cho – nhận e ở mỗi điện cực.
B3: Áp dụng phương pháp cân bằng electron để viết PT điện phân.
1. Điện phân nóng chảy
Ví dụ: Điện phân $A{{l}_{2}}{{O}_{3}}~$nóng chảy pha thêm criolit ($N{{a}_{3}}Al{{F}_{6}}$) có thể biểu diễn bằng sơ đồ:
|
Catot (–) |
← $A{{l}_{2}}{{O}_{3}}~$→ |
Anot (+) |
|
$A{{l}^{3+}}~+\,\,3e\to Al~~$ |
|
$2{{O}^{2-}}~\to {{O}_{2}}~+\,\,4e$ |
Phương trình điện phân là: $2A{{l}_{2}}{{O}_{3}}~\to ~4Al\text{ }+\text{ }3{{O}_{2}}$
2. Điện phân dung dịch
a) Quá trình điện phân ở catot: khử cation (sau Al): ${{M}^{n+}}~+\text{ }ne\to M~$
- Nếu điện phân dung dịch có các cation${{K}^{+}}$, $N{{a}^{+}}$, $C{{a}^{2+}}$, $B{{a}^{2+}}$, $M{{g}^{2+}}$, $A{{l}^{3+}}$thì ${{H}_{2}}O$sẽ tham gia điện phân theo PT: $2{{H}_{2}}O\text{ }+\text{ }2e\to {{H}_{2}}~+\text{ }2O{{H}^{-}}~$
- Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước (tuân theo dãy điện hoá).
Ví dụ: Điện phân dung dịch mà catot chứa các cation sau: $N{{a}^{+}}$, $F{{e}^{2+}}$, $C{{u}^{2+}}$,${{H}^{+}}$. Thứ tự điện phân:
$\begin{array}{*{20}{l}}{C{u^{2 + }}\; + {\rm{ }}2e \to Cu\;}\\{2{H^ + } + {\rm{ }}2e \to {H_2}\;}\\{F{e^{2 + }}\; + {\rm{ }}2e \to Fe}\\{{H_2}O{\rm{ }} + {\rm{ }}2e \to {H_2} + \;O{H^ - }\;}\end{array}$
$N{{a}^{+}}$không bị điện phân
b) Quá trình điện phân ở anot: oxi hóa anion: ${{X}^{n-}}~\to X\text{ }+\text{ }ne~~$
* Gốc axit không chứa oxi $\mathbf{C}{{\mathbf{l}}^{-}},{{\mathbf{S}}^{\mathbf{2}-}}$... hoặc ion $\mathbf{O}{{\mathbf{H}}^{-}}$của bazơ kiềm hoặc nước thì tham gia điện phân.
- Thứ tự anion bị oxi hóa: ${{S}^{2-}}>{{I}^{-}}>B{{r}^{-}}>C{{l}^{-}}>RCO{{O}^{-}}>O{{H}^{-}}>{{H}_{2}}O$
* Gốc axit có chứa $\mathbf{N}{{\mathbf{O}}_{\mathbf{3}}}^{-},\text{ }\mathbf{S}{{\mathbf{O}}_{\mathbf{4}}}^{\mathbf{2}},\text{- }\mathbf{P}{{\mathbf{O}}_{\mathbf{4}}}^{\mathbf{3-}},\text{ }\mathbf{C}{{\mathbf{O}}_{\mathbf{3}}}^{\mathbf{2-}},\text{ }\mathbf{Cl}{{\mathbf{O}}_{\mathbf{4}}}^{-}\ldots $ thì nước tham gia điện phân.
$2{{H}_{2}}O\to {{O}_{2}}~+\text{ }4{{H}^{+}}~+\text{ }4e~$
c) Ví dụ về điện phân dung dịch
- Điện phân dung dịch NaCl bão hòa với điện cực trơ có màng ngăn có thể biểu diễn bằng sơ đồ:
|
Catot (–) |
← NaCl → |
Anot (+) |
|
${{H}_{2}}O$, Na+ $2{{H}_{2}}O\text{ }+\text{ }2e\to ~{{H}_{2}}~+2O{{H}^{-}}$ |
${{H}_{2}}O$ |
$C{{l}^{-}},\text{ }{{H}_{2}}O~$ $2C{{l}^{-}}~~\to C{{l}_{2~}}+\text{ }2e$ |
Phương trình điện phân: $2NaCl\text{ }+\text{ }2{{H}_{2}}O~\to ~2NaOH\text{ }+\text{ }{{H}_{2}}~+\text{ }C{{l}_{2}}~$
Nếu không có màng ngăn thì: $C{{l}_{2}}~+\text{ }2NaOH\to ~NaCl\text{ }+\text{ }NaClO\text{ }+\text{ }{{H}_{2}}O$
=> phương trình điện phân: $NaCl\text{ }+\text{ }{{H}_{2}}O\to ~NaClO\text{ }+\text{ }{{H}_{2}}~$
3. Định luật Faraday
Khối lượng chất giải phóng ở mỗi điện cực tỉ lệ với điện lượng đi qua dung dịch và đương lượng của chất: $m=\frac{A.I.t}{n.F}$
Trong đó:
+ m: khối lượng chất giải phóng ở điện cực (gam)
+ A: khối lượng mol nguyên tử của chất thu được ở điện cực
+ n: số electron mà nguyên tử hoặc ion đã cho hoặc nhận
+ I: cường độ dòng điện (A)
+ t: thời gian điện phân (s)
+ F: hằng số Faraday (F = 1,602.10-19.6,022.1023 ≈ 96500 C.mol-1)
Biểu thức liên hệ:
$n=\frac{I.t}{F}$
4. Ứng dụng điện phân
- Điều chế kim loại.
- Điều chế một số phi kim: ${{H}_{2}},\text{ }{{O}_{2}},\text{ }{{F}_{2}},\text{ }C{{l}_{2}}.$
- Điều chế một số hợp chất: NaOH, Ja-ven.
- Tinh chế kim loại: Cu, Pb, Zn, Fe, Ag, Au.
- Mạ điện: Cu, Ag, Au, Cr, Ni.
Bài tập tự luyện có đáp án
Câu 1: Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch muối của chúng là
- A
- B
- C
- D
Những kim loại thoả mãn là kim loại yếu hơn Al (xét về tính khử)
Theo đề bài, đó là Fe, Cu, Ag
Câu 2: Dãy các kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
- A
- B
- C
- D
Những kim loại thoả mãn là kim loại yếu hơn Al (xét về tính khử)
Theo đề bài, đó là Ni, Fe, Pb
Câu 3: Hãy cho biết phản ứng điều chế kim loại nào sau đây không thuộc phương pháp nhiệt luyện?
- A
- B
- C
- D
Phản ứng $2CuS{O_4} + 2{H_2}O\xrightarrow{{dpdd}}2Cu + 2{H_2}S{O_4} + {O_2}$ thuộc phương pháp điện phân.
Câu 4: Cho các ion sau: $ C{{a}^{2+}},{{K}^{+}},C{{u}^{2+}},S{{O}_{4}}^{2-},N{{O}_{3}}^{-},Br^{-}.$ Trong dung dịch những ion nào không bị điện phân?
- A
- B
- C
- D
Các cation có tính oxi hóa yếu hơn nước không bị điện phân ( thường là ion của kim loại kiềm, kiềm thổ, $ A{{l}^{3+}}) $
Các anion chứa oxi thường không bị điện phân bên anot
Trong dung dịch những ion không bị điện phân là $ C{{a}^{2+}},{{K}^{+}},S{{O}_{4}}^{2-},N{{O}_{3}}^{-}. $
Câu 5: Kim loại nào sau đây điều chế bằng phương pháp nhiệt luyện?
- A
- B
- C
- D
Kim loại điều chế bằng phương pháp nhiệt luyện khi dùng CO khử oxit kim loại là Fe.
Câu 6: Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy?
- A
- B
- C
- D
Trong công nghiệp, kim loại Ca được điều chế bằng phương pháp điện phân nóng chảy.
Câu 7: Trong phương pháp nhiệt luyện người ta dùng chất khử là
- A
- B
- C
- D
Chất khử được dùng trong phương pháp nhiệt luyện là $ C,CO,{{H}_{2}},Al $
Câu 8: Trong dung dịch chứa đồng thời $ N{{a}^{+}},C{{u}^{2+}},A{{g}^{+}},F{{e}^{2+}},F{{e}^{3+}} $ , thứ tự điện phân các cation là
- A
- B
- C
- D
Trong dung dịch điện phân thì các ion có tính oxi hóa mạnh hơn nước sẽ bị điện phân gồm $ C{{u}^{2+}},A{{g}^{+}},F{{e}^{3+}} $.
Các ion có tính oxi hóa càng mạnh thì điện phân trước : thứ tự điện phân là $ A{{g}^{+}},F{{e}^{3+}},C{{u}^{2+}},F{{e}^{2+}} $.
Câu 9: Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
- A
- B
- C
- D
Trong công nghiệp, Fe được điều chế bằng phương pháp nhiệt luyện.
Câu 10: Dãy các kim loại nào sau đây đều được điều chế bằng phương pháp thủy luyện?
- A
- B
- C
- D
các kim loại được điều chế bằng phương pháp thủy luyện thường là các kim loại quý hiếm như: Cu, Ag, Au
Câu 11: Dãy các kim loại đều có thể được điều chế bằng phương pháp điện phân dung dịch là
- A
- B
- C
- D
Những kim loại thoả mãn là kim loại yếu hơn Al (xét về tính khử)
Theo đề bài, đó là Fe, Cu, Ag.
Câu 12: Ở nhiệt độ cao, CO có thể khử được oxit nào sau đây?
- A
- B
- C
- D
Ở nhiệt độ cao, CO có thể khử được oxit $ F{{e}_{2}}{{O}_{3}}. $
Câu 13: Nguyên tắc chung để điều chế kim loại là
- A
- B
- C
- D
Nguyên tắc chung để điều chế kim loại là thực hiện sự khử các ion kim loại
Câu 14: Phản ứng nào sau đây thể hiện cách điều chế kim loại Cu theo phương pháp thủy luyện?
- A
- B
- C
- D
$ Zn\text{ }+\text{ }CuS{{O}_{4}}\to ZnS{{O}_{4}}+\text{ }Cu $.
Câu 15: Ở nhiệt độ cao, $ {{H}_{2}} $ khử được oxit nào sau đây?
- A
- B
- C
- D
$ {{H}_{2}}+CuO\xrightarrow{{{t}^{o}}}Cu+{{H}_{2}}O $
Câu 16: Để điều chế các kim loại Na, Mg, Ca trong công nghiệp, người ta dùng cách nào trong các cách nào sau đây?
- A
- B
- C
- D
Các kim loại Na, Mg, Ca, K đều có tính khử mạnh khả năng tương tác với nước hoặc hơi nước nên không dùng điện phân dung dịch để điều chế và không dùng phương pháp đẩy muối (thủy luyện)
Câu 17: Kim loại nào sau đây được điều chế bằng phương pháp thủy luyện?
- A
- B
- C
- D
Phương pháp thủy luyện thường dùng để điều chế các kim loại sau Mg (thường là kim loại yếu). Vậy kim loại Cu được điều chế bằng phương pháp thủy luyện.
Câu 18: Kim loại nào sau đây điều chế được bằng phương pháp nhiệt luyện?
- A
- B
- C
- D
Kim loại điều chế được bằng phương pháp nhiệt luyện là Cu.
Câu 19: Cho các kim loại sau: Na, Ca, Al, Fe, Cu, Ag. Số kim loại có thể điều chế được bằng phương pháp điện phân là
- A
- B
- C
- D
Na, Ca và Al có thể điều chế bằng điện phân nóng chảy
Fe, Cu, Ag có thể điều chế bằng điện phân dung dịch.
Câu 20: Nhóm các kim loại đều có thể được điều chế bằng phương pháp thủy luyện là
- A
- B
- C
- D
Nhóm các kim loại đều có thể được điều chế bằng phương pháp thủy luyện là Cu, Ag.
Câu 21: Dãy nào sau đây gồm các ion không bị thủy phân phân trong dung dịch?
- A
- B
- C
- D
các ion không bị thủy phân trong dung dịch là $ N{{a}^{+}},C{{l}^{-}},{{K}^{+}}.$
Câu 22: Điện phân nóng chảy NaOH với các điện cực trơ, quá trình xảy ra ở catot là
- A
- B
- C
- D
Quá trình xảy ra ở catot là: $ N{{a}^{+}}+\text{1}e\to Na. $
Câu 23: Kim loại nào sau đây được điều chế bằng phương pháp thủy luyện?
- A
- B
- C
- D
Phương pháp thủy luyện thường dùng để điều chế các kim loại sau Mg (thường là kim loại yếu). Vậy kim loại Cu được điều chế bằng phương pháp thủy luyện.
Câu 24: Kim loại nào sau đây điều chế bằng cách dùng CO khử oxit kim loại ở nhiệt độ cao?
- A
- B
- C
- D
Kim loại điều chế bằng phương pháp nhiệt luyện khi dùng CO khử oxit kim loại là Fe.
Câu 25: Kim loại nào sau đây hiện nay được điều chế chủ yếu bằng phương pháp nhiệt luyện?
- A
- B
- C
- D
Kim loại được điều chế chủ yếu bằng phương pháp nhiệt luyện là Fe.
Xem thêm các bài tiếp theo bên dưới