Etilen - dãy đồng đẳng của etilen
Lý thuyết về Etilen - dãy đồng đẳng của etilen
ETILEN
Công thức phân tử: C2H4
I. Tính chất vật lí
- Etilen là chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (d=2829)
II. Cấu tạo phân tử.
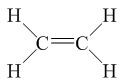
- Trong phân tử etilen, mỗi nguyên tử cacbon liên kết với hai nguyên tử hiđro, hai hóa trị còn lại dùng để liên kết hai nguyên tử cacbon với nhau.
- Công thức cấu tạo của etilen:
Viết gọn: CH2=CH2
- Giữa hai nguyên tử cacbon có hai liên kết. Những liên kết như vậy gọi là liên kết đôi
- Trong liên kết đôi, có một liên kết kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học
- Các hiđrocacbon có cấu tạo giống etilen (trong phân tử có một liên kết đôi) thì có tính chất hóa học tương tự etilen và được gọi chung là anken.
III. Tính chất hóa học
1. Tác dụng với oxi (phản ứng cháy)
Tương tự metan, etilen cháy tạo ra khí cacbonic, hơi nước và phản ứng tỏa nhiệt
C2H4(k)+3O2(k)to→2CO2(k)+2H2O(h)
2. Tác dụng với dung dịch brom (mất màu dung dịch brom)
- Thí nghiệm: Dẫn khí etilen qua dung dịch brom màu da cam, thấy dung dịch brom bị mất màu
- Giải thích: do etilen đã phản ứng với brom trong dung dịch
Viết gọn: CH2=CH2+Br2(dd)→Br−CH2−CH2−Br(l)etilenbromdibrometan
- Như vậy, liên kết kém bền trong liên kết đôi bị đứt ra, mối phân tử etilen đã cộng thêm một phân tử brom. Phản ứng trên gọi là phản ứng cộng
- Ngoài brom, etilen còn tác dụng với một số chất khác như hiđro, clo
CH2=CH2(k)+H2(k)to;xt:Ni→CH3−CH3(k)
3. Các phân tử etilen kết hợp với nhau (phản ứng trùng hợp)
Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác), liên kết kém bền trong phân tử etilen bị đứt ra. Khi đó, các phân tử etilen kếp hợp với nhau tạo thành phân tử có kích thước và khối lượng rất lớn gọi là poli etilen (viết tắt là PE)
…+ CH2=CH2+CH2=CH2+CH2=CH2 +…Xt,to,apsuat→ …−CH2−CH2−CH2−CH2−CH2−CH2− …
Phản ứng trên gọi là phản ứng trùng hợp.
Bài tập tự luyện có đáp án
Câu 1: Ứng dụng nào sau đây không phải ứng dụng của etilen?
- A
- B
- C
- D
Ứng dụng không phải ứng dụng của etilen là: Điều chế khí gas.
Câu 2: Có các tính chất hóa học sau:
(1) Tác dụng với khí clo khi chiếu sáng.
(2) Tham gia phản ứng cháy.
(3) Tham gia phản ứng cộng.
(4) Tham gia phản ứng trùng hợp.
Các tính chất hóa học của C2H4 là
- A
- B
- C
- D
Các tính chất hóa học của C2H4 là: (2), (3), (4).
Phương trình hóa học:
(2)C2H4+3O2t0→2CO2+2H2O
(3)C2H4+Br2→C2H4Br2
(4)nC2H4t0,p,xt→−(−CH2−CH2−)−n
Câu 3: Chất có liên kết đôi dễ tham gia phản ứng
- A
- B
- C
- D
Chất có liên kết đôi dễ tham gia phản ứng cộng do trong liên kết đôi chứa liên kết kém bền.
Câu 4: Phát biểu nào sau đây nói về tính chất vật lí của etilen?
- A
- B
- C
- D
Tính chất vật lí của etilen là : Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
Câu 5: Phương trình hóa học nào sau đây không đúng?
- A
- B
- C
- D
phương trình hoá học viết sai là: CH2=CH2+Br2→CH3−CHBr2
Đúng phải là : CH2=CH2+Br2→CH2Br−CH2Br
Câu 6: Trong phân tử etilen giữa hai nguyên tử cacbon có
- A
- B
- C
- D
Etilen: H−C|=C|−HHH
Trong phân tử etilen giữa hai nguyên tử cacbon có một liên kết đôi.
Câu 7: Hiện tượng xảy ra khi dẫn khí C2H4 qua dd Br2 là
- A
- B
- C
- D
Hiện tượng xảy ra khi dẫn khí C2H4 qua dd Br2 là : Dung dịch brom bị mất màu nâu
Do C2H4 phản ứng với dung dịch Br2 làm mất màu nâu của dung dịch brom
CH2=CH2+Br2→Br−CH2−CH2−Br
Xem thêm các bài tiếp theo bên dưới