So sánh tính chất hóa học các nguyên tố trong bảng tuần hoàn
Lý thuyết về So sánh tính chất hóa học các nguyên tố trong bảng tuần hoàn
I/ TÍNH KIM LOẠI, TÍNH PHI KIM
1/ Tính kim loại – phi kim :
Tính kim loại : Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường e để trở thành ion dương.
- Nguyên tử càng dễ nhường e thì tính kim loại càng mạnh
Tính phi kim: Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận thêm e để trở thành ion âm.
- Nguyên tử càng dễ nhận electron thì tính phi kim càng mạnh.
- Ranh giới tương đối giữa nguyên tố kim loại, phi kim trong bảng tuần hoàn các nguyên tố hóa học được phân chách bằng đường dích dắc in đậm. Phía phải là nguyên tố phi kim, phía trái là các nguyên tố kim loại
2/ Sự biến đổi tính chất trong một chu kì:
- Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố yếu dần, tính phi kim tăng dần
Giải thích : Trong một chu kì, từ trái sang phải, Z+ tăng nhưng số lớp electron của nguyên tử các nguyên tố bằng nhau, do đó lực hút của hạt nhân với các electron lớp ngoài cùng tăng lên làm cho bán kính giảm dần, khả năng nhường e (đặc trưng cho tính kim loại) giảm dần và khả năng thu electron (đặc trưng cho tính phi kim) tăng dần.
3/ Sự biến đổi tính chất trong một nhóm A
- Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố mạnh dần, đồng thời tính phi kim yếu dần.
- Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, điện tích hạt nhân tăng, nhưng đồng thời số lớp electron cũng làm tăng bán kinh nguyên tử các nguyênt ố nhanh và chiếm ưu thế hơn nên khả năng nhường electron của các nguyên tố càng tăng lên – tính kim loại tăng và khả năng nhận electron của các nguyên tố giảm – tính phi kim giảm
- Cs có tính kim loại mạnh nhất, F có tính phi kim mạnh nhất
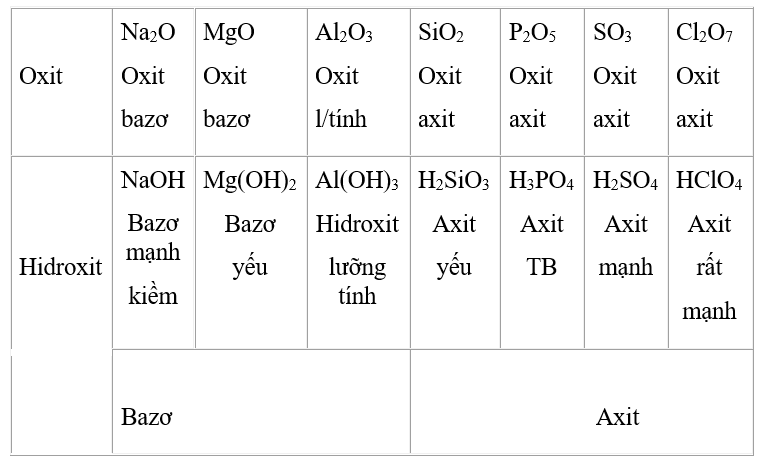
II/ SỰ BIẾN ĐỔI TÍNH AXIT-BAZƠ CỦA OXIT VÀ HIĐROXIT
Trong 1 chu kì: từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, tính bazơ của oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
- · Trong 1 nhóm A : Đi từ trên xuống, theo chiều tăng dần điện tích hạt nhân : tính bazơ của các oxit và hidroxit tăng, tính axit giảm dần
Bài tập tự luyện có đáp án
Câu 1: Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì
- A
- B
- C
- D
Flo có tính phi kim mạnh nhất
Câu 2: Trong các nguyên tố sau, nguyên tố nào có độ âm điện nhỏ nhất:
- A
- B
- C
- D
Trong một chu kì độ âm điện tăng dần từ trái sang phải. → C < N < O < F.
Câu 3: Trong cùng phân nhóm chính (nhóm A), theo chiều điện tích hạt nhân tăng dần :
- A
- B
- C
- D
Trong cùng phân nhóm chính (nhóm A), theo chiều điện tích hạt nhân tăng dần tính kim loại tăng, tính phi kim giảm
Câu 4: Trong 1 chu kì, bán kính nguyên tử các nguyên tố
- A
- B
- C
- D
Trong một chu kì, bán kính nguyên tử của các nguyên tố giảm dần theo chiều tăng của điện tích hạt nhân.
Câu 5: Chất nào dưới đây có tính axit mạnh nhất ?
- A
- B
- C
- D
P, S, Cl cùng chu kì nên H3PO4<H2SO4<HClO4 , mà H2CO3 là axit yếu, yếu hơn axit H2SO4
HClO4 có tính axit mạnh nhất trong các axit trên
Câu 6: Trong một nhóm A (trừ nhóm VIIIA) theo chiều tăng của điện tích hạt nhân nguyên tử thì
- A
- B
- C
- D
Trong một nhóm A (trừ nhóm VIIIA) theo chiều tăng dần điện tích hạt nhân thì tính phi kim giảm dần, bán kính nguyên tử tăng dần
Câu 7: Chất nào dưới đây có tính bazơ yếu nhất ?
- A
- B
- C
- D
+ K và Ca cùng chu kì nên tính bazơ của KOH mạnh hơn Ca(OH)2
+ Mg và Ca cùng nhóm nên Ca(OH)2 mạnh hơn Mg(OH)2
+ Mg và Al cùng chu kì nên Mg(OH)2 mạnh hơn Al(OH)3
Al(OH)3 có tính bazơ yếu nhất trong các bazơ trên
Câu 8: Trong cùng phân nhóm chính (nhóm A), theo chiều điện tích hạt nhân tăng dần :
- A
- B
- C
- D
Trong cùng phân nhóm chính (nhóm A), theo chiều điện tích hạt nhân tăng dần tính bazơ của oxit và hiđroxit tương ứng tăng dần, đồng thời tính axit của chúng giảm dần.
Câu 9: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất tạo nên từ các nguyên tố đó
- A
- B
- C
- D
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân
Câu 10: Trong chu kì, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân
- A
- B
- C
- D
Trong chu kì, từ trái sang phải, điện tích hạt nhân tăng dần tính kim loại giảm, tính phi kim tăng
Câu 11: Trong cùng một chu kì, theo chiều điện tích hạt nhân tăng dần :
- A
- B
- C
- D
Trong cùng phân nhóm chính (nhóm A), theo chiều điện tích hạt nhân tăng dần tính kim loại giảm, tính phi kim tăng
Câu 12: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
- A
- B
- C
- D
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân bán kính nguyên tử giảm dần, tính phi kim tăng dần
Câu 13: Trong chu kì, từ trái sang phải, theo chiều điện tích hạt nhân tăng dần:
- A
- B
- C
- D
Trong chu kì, từ trái sang phải, điện tích hạt nhân tăng dần tính bazơ của oxit và hiđroxit tương ứng giảm dần, đồng thời tính axit của chúng tăng dần.
Câu 14: Oxit nào dưới đây có tính bazơ nhỏ nhất ?
- A
- B
- C
- D
Li, Na, K, Cs cùng thuộc nhóm IA, điện tích hạt nhân tăng dần nên tính bazo của oxit cũng tăng dần → Tính bazơ của Li2O là nhỏ nhất.
Câu 15: Chất nào dưới đây có tính bazơ mạnh nhất ?
- A
- B
- C
- D
Be, Ca, Sr, Ba cùng thuộc nhóm IIA, điện tích hạt nhân tăng nên tính bazơ của hiđroxit tăng
⇒ Ba(OH)2 có tính bazơ mạnh nhất trong các bazo trên
Câu 16: Nguyên tố nào có tính kim loại mạnh nhất trong số các kim loại dưới đây
- A
- B
- C
- D
Cs có tính kim loại mạnh nhất
Câu 17: Các nguyên tố từ Na đến Cl, theo chiều tăng của điện tích hạt nhân thi
- A
- B
- C
- D
Na đến Cl là cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kinh nguyên tử giảm, độ âm điện tăng
Câu 18: Oxit nào dưới đây có tính bazơ lớn nhất ?
- A
- B
- C
- D
Be, Ca, Sr, Ba cùng thuộc nhóm IIA, điện tích hạt nhân tăng nên tính bazơ của oxit tăng
⇒ BaO có tính bazơ mạnh nhất trong các oxit bazo trên
Câu 19: Tính chất nào sau đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử của các nguyên tố trong bảng tuần hoàn?
- A
- B
- C
- D
Nguyên tử khối không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân của các nguyên tố trong bảng tuần hoàn
Câu 20: Trong một chu kì, khi đi từ trái sang phải, bán kính nguyên tử giảm dần do
- A
- B
- C
- D
Trong một chu kì, đi từ trái sang phải bán kính nguyên tử giảm do điện tích tăng dần và số lớp không đổi dẫn đến lực hút của hạt nhân và e tang dần dẫn đến bán kính giảm
Câu 21: Nguyên tử nào dưới đây có độ âm điện lớn hơn 17Cl ?
- A
- B
- C
- D
F, Cl cùng thuộc nhóm VIIA mà ZF<ZCl → Độ âm điện của 9F>17Cl (do độ âm điện giảm dần từ trên xuống dưới)
Câu 22: Trong một nhóm A, theo chiều tăng của điện tích hạt nhân
- A
- B
- C
- D
Trong cùng phân nhóm chính (nhóm A), theo chiều điện tích hạt nhân tăng dần tính kim loại tăng, tính phi kim giảm
Câu 23: Trong bảng tuần hoàn, nguyên tố có tính kim loại mạnh nhất và nguyên tố có độ âm điện lớn nhất lần lượt là:
- A
- B
- C
- D
Trong bảng tuần hoàn
Kim loại mạnh nhất là Cs
Nguyên tố có độ âm điện lớn nhất là F
Câu 24: Trong bảng hệ thống tuần hoàn, nguyên tố nào sau đây có độ âm điện lớn nhất?
- A
- B
- C
- D
Trong bảng tuần hoàn F có độ âm điện lớn nhất
Xem thêm các bài tiếp theo bên dưới