Khái quát về nhóm halogen
Lý thuyết về Khái quát về nhóm halogen
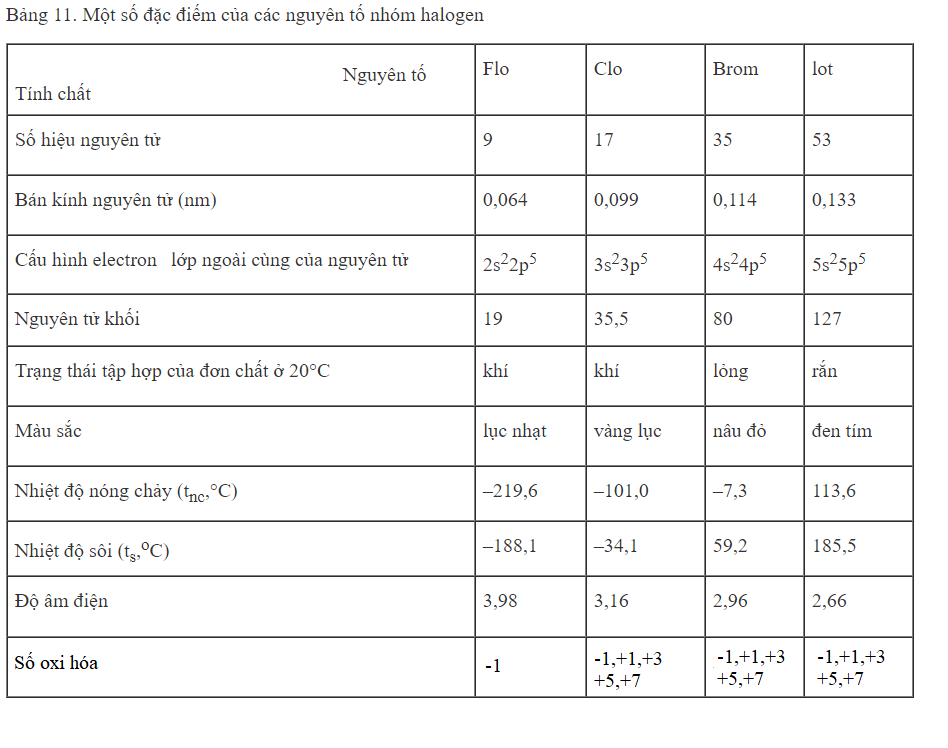
- Vị trí của nhóm halogen trong bảng tuần hoàn
- Nhóm halogen gồm : Flo (F), Clo (Cl), Brom (Br), Iot (I), attain (At, nguyên tố phóng xạ)
- Nhóm halogen là nhóm VIIA
- Cấu hình electron:
- Cấu hình lớp ngoài cùng : ns2np5
- Ở trạng thái tự do, phân tử có cấu tạo X2 (X là nguyên tố halogen)
- Sự biến đổi tính chất.
- Tính chất vật lý
- Tính chất hóa học
- Do cấu hình electron lớp ngoài cùng giống nhau nên các đơn chất halogen có tính chất giống nhau
- Halogen là phi kim điểm hình. Từ F đến I, tính oxi hóa giảm
- Đơn chất halogen oxi hóa được hầu hết các kim loại, khí hiđro.
Bài tập tự luyện có đáp án
Câu 1: Tính chất hóa học cơ bản của các nguyên tố nhóm halogen là
- A
- B
- C
- D
Tính chất hóa học cơ bản của các nguyên tố nhóm halogen là tính oxi hóa mạnh
Câu 2: Trong nhóm halogen, sự biến đổi tính chất nào sau đây của đơn chất đi từ flo đến iot là đúng?
- A
- B
- C
- D
Trong nhóm halogen, đi từ flo đến iot trạng thái tập hợp chuyển từ thể khí sang thể lỏng và rắn.
Câu 3: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2)?
- A
- B
- C
- D
Nguyên tử của các nguyên tố nhóm halogen có 7 e ở lớp ngoài cùng, dễ dàng nhận thêm 1 electron để đạt trạng thái cấu hình khí hiếm bền vững→ Có tính oxi hóa mạnh.
Câu 4: Cấu hình electron lớp ngoài cùng của nhóm halogen là
- A
- B
- C
- D
Cấu hình electron lớp ngoài cùng của nhóm Halogen là ns2np5
Câu 5: Dãy nào sau đây sắp xếp theo chiều tăng dần tính oxi hoá của các halogen?
- A
- B
- C
- D
Tính oxi hoá của các halogen biến thiên I2<Br2<Cl2<F2.
Câu 6: Nguyên tố nào trong số những nguyên tố sau có độ âm điện lớn nhất?
- A
- B
- C
- D
Trong nhóm halogen, flo có độ âm điện lớn nhất
Câu 7: Nguyên tố nào sau đây trong tất cả các hợp chất chỉ có số oxi hoá –1 ?
- A
- B
- C
- D
Flo có số oxi hóa -1 và hóa trị 1 trong mọi hợp chất.
Câu 8: Các halogen có tính chất hóa học gần giống nhau vì có cùng
- A
- B
- C
- D
Các halogen có tính chất hóa học gần giống nhau vì có cùng 7 e lớp ngoài cùng
Câu 9: Trong các nguyên tố dưới đây, nguyên tử của nguyên tố nào có xu hướng kết hợp với electron mạnh nhất ?
- A
- B
- C
- D
Flo là phi kim mạnh nhất → Xu hướng kết hợp electron mạnh nhất.
Câu 10: Chọn phát biểu đúng?
- A
- B
- C
- D
Clo là khí màu vàng lục
Câu 11: Theo dãy: F2−Cl2−Br2−I2 thì
- A
- B
- C
- D
Trong một nhóm, đi từ đầu đến cuối nhóm, tính oxi hóa giảm dần, tính khử tăng dần
Câu 12: Trong các phản ứng hóa học, để chuyển thành anion, nguyên tử của các nguyên tố Halogen đã nhận hay nhường bao nhiêu electron ?
- A
- B
- C
- D
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tử của các nguyên tố Halogen đã nhận thêm 1e
Câu 13: Trong các halogen, clo là nguyên tố
- A
- B
- C
- D
Clo ở dạng muối NaCl, có rất nhiều trong nước biển
Câu 14: Theo chiều từ Flo → Clo → Brom → Iot, bán kính nguyên tử của các nguyên tố
- A
- B
- C
- D
Theo chiều từ Flo → Clo → Brom → Iot, bán kính nguyên tử của các nguyên tố tăng dần và độ âm điện giảm dần
Câu 15: Các nguyên tử Halogen đều có:
- A
- B
- C
- D
Các nguyên tử Halogen đều có 7e ở lớp ngoài cùng
Câu 16: Trong tự nhiên, các halogen
- A
- B
- C
- D
Trong tự nhiên, các halogen chỉ tồn tại ở dạng hợp chất
Câu 17: Liên kết hóa học trong phân tử flo, clo, brom, iot, đều là:
- A
- B
- C
- D
Liên kết hóa học trong phân tử flo, clo, brom, iot, đều là liên kết cộng hóa trị không cực
Câu 18: Đặc điểm nào đưới đây không phải là đặc điểm chung của các nguyên tố nhóm halogen (F, Cl, Br, I)
- A
- B
- C
- D
Cl, Br, I ngoài số oxi hóa -1 còn các số oxi hóa +1,+3,+5,+7 trong các hợp chất
Câu 19: Những nguyên tố ở nhóm nào có cấu hình e lớp ngoài cùng là ns2np5 ?
- A
- B
- C
- D
Nhóm Halogen cấu hình e lớp ngoài cùng là ns2np5
Câu 20: Cho 4 đơn chất F2;Cl2;Br2;I2 . Chất có nhiệt độ sôi cao nhất là
- A
- B
- C
- D
Chất có nhiệt độ sôi cao nhất là iot
Câu 21: Nhận xét nào sau đây về nhóm halogen là không đúng:
- A
- B
- C
- D
Halogen chỉ tồn tại ở dạng hợp chất mà không tồn tại ở dạng đơn chất nên nói chủ yếu là không đúng
Câu 22: Vị trí của các nguyên tố nhóm halogen trong bảng tuần hoàn là
- A
- B
- C
- D
Các nguyên tố nhóm halogen thuộc nhóm VIIA, cuối các chu kì, trước các nguyên tố khí hiếm
Câu 23: Dãy nào sau đây sắp xếp theo chiều giảm dần tính khử của các ion halogenua?
- A
- B
- C
- D
Tính khử của các halogenua giảm dần theo thứ tự I−>Br−>Cl−>F−