Lý thuyết chung về anken
Lý thuyết về Lý thuyết chung về anken
ANKEN (OLEFIN)
I. ĐỒNG ĐẲNG
- Anken là các hiđrocacbon không no, mạch hở, trong phân tử có 1 liên kết đôi C = C.
- Các anken có công thức chung là \[{{C}_{n}}{{H}_{2n}}\] (n $\ge $ 2).
II. ĐỒNG PHÂN
a. Đồng phân cấu tạo
- Các anken \[{{C}_{2}},{{C}_{3}}\] không có đồng phân.
- Từ \[{{C}_{4}}\] trở đi có đồng phân mạch C và đồng phân vị trí liên kết đôi.
b. Đồng phân hình học
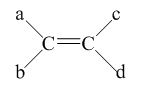
- Gồm 2 loại : Đồng phân cis (các nhóm thế có khối lượng lớn nằm cùng phía) và trans (các nhóm thế có khối lượng lớn nằm khác phía).
● Điều kiện để có đồng phân hình học :
Điều kiện để xuất hiện đồng phân hình học là : a ≠ b và c ≠ d
III. DANH PHÁP
1. Tên thông thường
- Một số ít anken có tên thông thường
Tên thông thường = Tên ankan tương ứng, thay đuôi “an” = “ ilen”
2. Tên thay thế của anken
Tên anken = Số chỉ vị trí nhánh + Tên nhánh + Tên mạch chính + vị trí liên kết đôi + en
- Mạch chính là mạch có chứa liên kết C = C và dài nhất, có nhiều nhánh nhất.
- Để xác định vị trí nhánh phải đánh số cacbon trên mạch chính.
+ Đánh số C trên mạch chính từ phía C đầu mạch gần liên kết C = C hơn.
IV. TÍNH CHẤT VẬT LÍ
- Anken từ \[{{C}_{2}}\to {{C}_{4}}\] ở trạng thái khí. An ken từ \[{{C}_{5}}\] trở lên ở trạng thái lỏng hoặc rắn.
- Nhiệt độ nóng chảy, sôi : Các anken có nhiệt độ nóng chảy và nhiệt độ sôi tăng dần theo M
- Độ tan : Các anken đều nhẹ hơn nước, không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ.
V. TÍNH CHẤT HÓA HỌC
Nhận xét chung :
- Do trong phân tử anken có liên kết C=C gồm 1 liên kết $\sigma $ và 1 liên kết $\pi $, trong đó liên kết $\pi $ kém bền hơn nên dễ bị phân cắt hơn trong các phản ứng hóa học. Vì vậy anken dễ dàng tham gia các phản ứng cộng vào liên kết C=C tạo thành hợp chất no tương ứng.
1. Phản ứng cộng
a. Cộng hiđro tạo ankan : \[{{C}_{n}}{{H}_{2n}}+{{H}_{2}}\] $\xrightarrow{{{\text{t}}^{\text{o}}}\text{, Ni}}$ \[{{C}_{n}}{{H}_{2n+2}}\]
b. Cộng halogen X2 (Cl2, Br2): \[{{C}_{n}}{{H}_{2n}}+{{X}_{2}}\] $\to $ \[{{C}_{n}}{{H}_{2n}}{{X}_{2}}\]
\[C{{H}_{2}}=C{{H}_{2}}+B{{r}_{2(dd)}}\to C{{H}_{2}}BrC{{H}_{2}}Br\]
● Do anken làm mất màu dung dịch Brom nên người ta dùng dung dịch Brom làm thuốc thử để nhận biết ra anken.
c. Cộng axit HX (HCl, HBr, HOH)
$ {{C}_{n}}{{H}_{2n}}+HX\to {{C}_{n}}{{H}_{2n+1}}X \\$
$ {{C}_{n}}{{H}_{2n}}+HOH\to {{C}_{n}}{{H}_{2n+1}}OH \\$
- Các anken có cấu tạo phân tử không đối xứng khi cộng HX có thể cho hỗn hợp hai sản phẩm.
● Quy tắc Maccopnhicop : Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (phần mang điện dương) chủ yếu cộng vào nguyên tử C bậc thấp hơn (có nhiều H hơn), còn nguyên hay nhóm nguyên tử X (phần mang điện âm) cộng vào nguyên tử C bậc cao hơn (ít H hơn).
2. Phản ứng trùng hợp
- Phản ứng trùng hợp là phản ứng cộng hợp nhiều phân tử nhỏ có cấu tạo tương tự nhau (gọi là monome) thành 1 phân tử lớn (gọi là polime): $nA\xrightarrow{{{t}^{o}},xt,p}-\left( A \right)-$
- n gọi là hệ số trùng hợp.
- Phần trong ngoặc gọi là mắt xích của polime.
● Điều kiện để monome tham gia phản ứng trùng hợp là phân tử phải có liên kết $\pi $.
3. Phản ứng oxi hóa
a. Phản ứng cháy
\[{{C}_{n}}{{H}_{2n}}+\frac{3n}{2}{{O}_{2}}\] $\xrightarrow{{{\text{t}}^{\text{0}}}}$ \[nC{{O}_{2}}+n{{H}_{2}}O\]
- Khi đốt anken luôn thu được : ${{n}_{C{{O}_{2}}}}={{n}_{{{H}_{2}}O}}$
b. Phản ứng oxi hóa không hoàn toàn
- Dẫn khí \[{{C}_{2}}{{H}_{4}}\] vào dung dịch \[KMn{{O}_{4}}\] (màu tím) thấy dung dịch mất màu tím :
\[3{{C}_{2}}{{H}_{4}}+2KMn{{O}_{4}}+4{{H}_{2}}O\to 3HOC{{H}_{2}}-C{{H}_{2}}OH+2Mn{{O}_{2}}+2KOH\]
- Phản ứng tổng quát : \[3{{C}_{n}}{{H}_{2n}}+2KMn{{O}_{4}}+4{{H}_{2}}O\to 3{{C}_{n}}{{H}_{2n}}{{\left( OH \right)}_{2}}+2Mn{{O}_{2}}+2KOH\]
● Phản ứng làm mất màu tím của dung dịch kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi anken.
VI. ĐIỀU CHẾ
1. Trong phòng thí nghiệm:
${{C}_{2}}{{H}_{5}}OH\xrightarrow{{{H}_{2}}S{{O}_{4}}\,\,dac,\,\,{{170}^{o}}C}C{{H}_{2}}=C{{H}_{2}}+{{H}_{2}}O$
2. Trong công nghiệp
\[{{C}_{n}}{{H}_{2n+2}}\] $\xrightarrow{{{t}^{o}},\,xt}$ \[{{C}_{n}}{{H}_{2n}}+{{H}_{2}}\]
Bài tập tự luyện có đáp án
Câu 1: Áp dụng quy tắc Maccopnhicop vào trường hợp nào sau đây?
- A
- B
- C
- D
Quy tắc Maccopnhicop áp dụng trong phản ứng cộng của $ HX $ vào anken bất đối xứng.
Câu 2: Cho phản ứng cracking: $ { C _ 4 }{ H _{10}}\to C{ H _ 4 }+X $ . Chất X có thể là:
- A
- B
- C
- D
Phương trình phản ứng:
$ { C _ 4 }{ H _{10}}\to C{ H _ 4 }+{ C _ 3 }{ H _ 6 } $
Câu 3: Cho etilen tác dụng với dung dịch $ { H _ 2 }S{ O _ 4 } $ ở nhiệt độ thường. Sản phẩm là:
- A
- B
- C
- D
Phương trình phản ứng: $ C{ H _ 2 }=C{ H _ 2 }+{ H _ 2 }S{ O _ 4 }\to C{ H _ 3 }-C{ H _ 2 }HS{ O _ 4 } $
Câu 4: Những hợp chất nào sau đây có đồng phân hình học (cis-trans)? $ C{ H _ 3 }CH=C{ H _ 2 }(I);C{ H _ 3 }CH=CHCl(II);C{ H _ 3 }CH=C{{(C{ H _ 3 })}_ 2 }(III);. $ $ { C _ 2 }{ H _ 5 }-C(C{ H _ 3 })=C(C{ H _ 3 })-{ C _ 2 }{ H _ 5 }(IV);{ C _ 2 }{ H _ 5 }-C(C{ H _ 3 })=CCl-C{ H _ 3 }(V) $
- A
- B
- C
- D
Điều kiện cho một chất có đồng phân hình học: 2 nhóm thế cùng đính với 1C của nối đôi phải khác nhau
$ \to $ (II); (IV); (V) thỏa mãn điều kiện
Câu 5: Chất X có công thức : \(C{H_3} - CH\left( {C{H_3}} \right) - CH = C{H_2}\). Tên thay thế của X là
- A
- B
- C
- D
Câu 6: $ { C _ 4 }{ H _ 8 } $ có bao nhiêu đồng phân cấu tạo là anken?
- A
- B
- C
- D
Các đồng phân:
$ C{ H _ 3 }-C{ H _ 2 }-CH=C{ H _ 2 } $
$ C{ H _ 3 }-CH=CH-C{ H _ 3 } $
$ C{ H _ 3 }-C(C{ H _ 3 })=C{ H _ 2 } $
Câu 7: Ở điều kiện thường, chất nào sau đây làm mất màu dung dịch $ KMn{{O}_{4}} $ ?
- A
- B
- C
- D
Ở điều kiện thường, chất làm mất màu dung dịch $ KMn{{O}_{4}} $ là etilen.
Câu 8: Anken X có công thức cấu tạo: \(C{H_3}-C{H_2}-C\left( {C{H_3}} \right) = CH-C{H_3}\). Tên của X là
- A
- B
- C
- D

Câu 9: Cho các chất sau: 2-metylbut-1-en (1); 3,3-đimetylbut-1-en (2); 3-metylpent-1-en (3); 3-metylpent-2-en (4); Những chất nào là đồng phân của nhau ?
- A
- B
- C
- D

Câu 10: Hiđrat hóa 2-metylbut-2-en (điều kiện nhiệt độ, xúc tác thích hợp) thu được sản phẩm chính là:
- A
- B
- C
- D
Phương trình phản ứng:
$ C{ H _ 3 }-C(C{ H _ 3 })=CH-C{ H _ 3 }+{ H _ 2 }O\to $ $ \left[ \begin{align} & C{ H _ 3 }-C(OH)(C{ H _ 3 })-C{ H _ 2 }-C{ H _ 3 }(spc-2-metylbu\tan -2-ol) \\ & C{ H _ 3 }-CH(C{ H _ 3 })-CH(OH)-C{ H _ 3 }(spp-2-metylbu\tan -3-ol) \\ \end{align} \right. $
Câu 11: Trùng hợp eten, sản phẩm thu được có cấu tạo là
- A
- B
- C
- D
Phương trình phản ứng: $ nC{ H _ 2 }=C{ H _ 2 }\xrightarrow{xt,{ t ^ 0 },p}{{(-C{ H _ 2 }-C{ H _ 2 }-)}_ n } $
Câu 12: Hợp chất $ { C _ 5 }{ H _{10}} $ có bao nhiêu đồng phân anken?
- A
- B
- C
- D
$ C{ H _ 2 }=CH-C{ H _ 2 }-C{ H _ 2 }-C{ H _ 3 }; $
$ C{ H _ 3 }-CH=CH-C{ H _ 2 }-C{ H _ 3 }; $ (có đồng phân hình học)
$ C{ H _ 3 }-C(C{ H _ 3 })=CH-C{ H _ 3 }; $
$ C{ H _ 2 }=C(C{ H _ 3 })-C{ H _ 2 }-C{ H _ 3 }; $
$ C{ H _ 3 }-CH(C{ H _ 3 })-CH=C{ H _ 2 }; $
Câu 13: Cho các chất sau: $ C{ H _ 2 }=CH-C{ H _ 2 }-C{ H _ 2 }-CH=C{ H _ 2 };C{ H _ 2 }=CH-CH=CH-C{ H _ 2 }-C{ H _ 3 }; $ $ C{ H _ 3 }-C(C{ H _ 3 })=CH-C{ H _ 3 };C{ H _ 2 }=CH-C{ H _ 2 }-CH=C{ H _ 2 } $ . Số chất có đồng phân hình học là:
- A
- B
- C
- D
Những chất có 2 nhóm thế khác nhau cùng đính vào 1C của nối đoi thì chất đó có đồng phân hình học.
$ \to $ những chất có đồng phân hình học: $ C{ H _ 2 }=CH-CH=CH-C{ H _ 2 }-C{ H _ 3 } $
Câu 14: Để phân biệt etan và eten, người ta dùng phản ứng nào sau đây ?
- A
- B
- C
- D
Eten làm mất màu dung dịch brom, etan không làm mất màu dung dịch brom
Câu 15: Cho các chất sau: propen, but-2-en, 2,3-đimetylbut-2-en, 2-metylpropen, hex-3-en. Số chất có đồng phân hình học là:
- A
- B
- C
- D
Propen: $ C{ H _ 2 }=CH-C{ H _ 3 } $
But-2-en: $ C{ H _ 3 }-CH=CH-C{ H _ 3 } $
2,3-đimetylbut-2-en: $ {{(C{ H _ 3 })}_ 2 }C=C{{(C{ H _ 3 })}_ 2 } $
2-metylpropen: $ C{ H _ 2 }=C{{(C{ H _ 3 })}_ 2 } $
Hex-3-en: $ C{ H _ 3 }-C{ H _ 2 }-CH=CH-C{ H _ 2 }-C{ H _ 3 } $
Điều kiện để một chất có đồng phân hình học là hai nhóm thế cùng đính vào 1C của nối đôi phải khác nhau
$ \to $ những chất có đồng phân hình học: but-2-en, hex-3-en