Clo
Lý thuyết về Clo
I. Tính chất vật lý.
- Clo là chất khí, màu vàng lục, mùi hắc, độc
- Clo nặng hơn 2,5 lần không khí và tan được trong nước
II. Tính chất hóa học
1. Clo tác dụng với kim loại
Clo tác dụng với hầu hết các kim loại tạo thành muối clorua
3Cl2(k)+2Fe(r)to→2FeCl3(r)
Cl2(k)+Cu(r)to→CuCl2(r)
2. Tác dụng với hiđro
H2(k)+Cl2(k)to→2HCl(k)
3. Tác dụng với nước
Cl2+H2O⇆HCl(dd)+HClO(dd)
Nước clo là dung dịch hỗn hợp các chất : Cl2,HCl,HClO nên có màu vàng, mùi hắc. Lúc đầu dung dịch làm quỳ tím hóa đỏ, nhưng nhanh chóng bị mất màu do tác dụng oxi hóa mạnh của axit hipoclorơ HClO
4. Tác dụng với dung dịch NaOH
Cl2+2NaOH→NaCl+NaClO+H2O
Hỗn hợp 2 muối NaCl và NaClO được gọi là nước Gia – ven. Dung dịch này có tính tẩy màu vì tương tự như HClO và NaClO là chất oxi hóa mạnh.
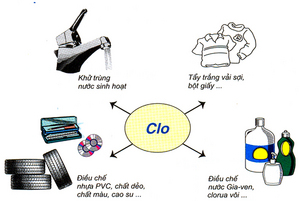
III. Ứng dụng của clo
IV. Điều chế
- Trong phòng thí nghiệm
4HCldamdac+MnO2(r)to→MnCl2(dd)+Cl2(k)+H2O(l)
- Điều chế clo trong công nghiệp
Điện phân dung dịch NaCl có màng ngăn
2NaCl+2H2O(l)dpddmn→Cl2+H2(k)+2NaOH(dd)
Bài tập tự luyện có đáp án
Câu 1: Nhận xét nào dưới đây không đúng về khí clo?
- A
- B
- C
- D
Nhận xét không đúng về khí clo là : Clo không tan trong nước vì clo tan trong nước.
Câu 2: Trong phòng thí nghiệm, khí clo thường được điều chế bằng cách oxi hoá chất nào sau đây?
- A
- B
- C
- D
Trong phòng thí nghiệm khí Cl2 thường được điều chế cách oxi hóa HCl
4HCl+MnO2→MnCl2+Cl2+2H2O
Câu 3: Công thức phân tử của khí clo là
- A
- B
- C
- D
Công thức phân tử của khí clo là Cl2
Câu 4: Thành phần nước Gia–ven gồm:
- A
- B
- C
- D
Thành phần của nước gia – ven gồm NaCl,NaClO,H2O
2NaOH+Cl2→NaCl+NaClO+H2O
Câu 5: Trong công nghiệp, người ta điều chế khí clo bằng cách nào?
- A
- B
- C
- D
Trong công nghiệp, người ta điều chế khí Cl2 bằng cách điện phân dung dịch NaCl bão hòa có màng ngăn xốp
2NaCl+H2Odpdd,mangngan→2NaOH+H2+Cl2
Câu 6: Điều chế khí clo trong phòng thí nghiệm, người ta cho dung dịch HCl phản ứng với
- A
- B
- C
- D
Điều chế khí Cl2 trong phòng thí nghiệm người ta cho HCl phản ứng với MnO2
4HCl+MnO2→MnCl2+2H2O+Cl2
Câu 7: Ứng dụng nào dưới đây không phải của clo?
- A
- B
- C
- D
Ứng dụng không phải của clo là : chế tạo diêm, đây là ứng dụng của lưu huỳnh
Câu 8: Nhận xét nào dưới đây về khí clo là đúng?
- A
- B
- C
- D
Nhận xét đúng là : Trong tự nhiên clo chỉ tồn tại ở dạng hợp chất
Câu 9: Hợp chất nào sau đây phản ứng được với clo?
- A
- B
- C
- D
2NaOH+Cl2→NaCl+NaClO+H2O
Câu 10: Nước Gia-ven là dung dịch trong nước của
- A
- B
- C
- D
Nước Gia-ven là dung dịch trong nước của NaClO và NaCl.