Sự hình thành liên kết ion
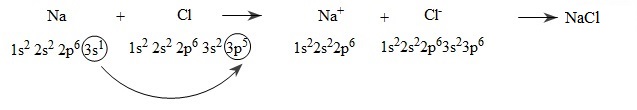
Lý thuyết về Sự hình thành liên kết ion
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
VD: Xét sự hình thành liên kết ion trong phân tử natriclorua (NaCl)
- Na(1s22s22p63s1) dễ nhường 1 electron cho nguyên tử Cl để biến đổi thành cation Na+ (1s22s22p6)
- Cl(1s22s22p63s23p5) dễ nhận 1 electron của nguyên tử Na để biến đổi thành anion Cl(1s22s22p63s23p6)
Quá trình biểu diễn như sau :
Bài tập tự luyện có đáp án
Câu 1: Nguyên tử nguyên tố X có cấu hình 1s22s22p4 . X khi hình thành liên kết ion sẽ tạo thành
- A
- B
- C
- D
Khi tham gia hình thành liên kết X có xu hướng nhận về 2 electron để đạt đến cấu hình của khí hiếm.
X+2e→X2−
Câu 2: Cho nguyên tử Oxi (Z = 8). Nội dung nào sau đây không đúng:
- A
- B
- C
- D
Phát biểu sai: Liên kết ion trong CaO được tạo thành do: Ca+2e→Ca2+;O→O2−+2e;Ca2++O2−→CaO
Đúng phải là: Liên kết ion trong CaO được tạo thành do: Ca→Ca2++2e;O+2e→O2−;Ca2++O2−→CaO
Câu 3: Cho nguyên tử Liti (Z = 3) . Nội dung nào sau đây không đúng:
- A
- B
- C
- D
Phát biểu sai: Nguyên tử khí hiếm Ne có cấu hình e giống Li+
Đúng phải là: Nguyên tử khí hiếm He có cấu hình e giống Li+
Câu 4: Nguyên tử nguyên tố X có Z=20. Khi hình thành liên kết hóa học X có xu hướng
- A
- B
- C
- D
X có cấu hình : 1s22s22p63s23p64s2 , 2 electron lớp ngoài cùng. Khi tham gia hình thành liên kết X có xu hướng nhường đi 2 electron để đạt đến cấu hình của khí hiếm.
X→X2++2e
Câu 5: Liên kết hóa học giữa các ion được gọi là:
- A
- B
- C
- D
Liên kết hóa học giữa các ion được gọi là liên kết ion.
Câu 6: Chọn phát biểu đúng nhất?
Liên kết hóa học trong NaCl được hình thành là do:
- A
- B
- C
- D
Liên kết hóa học trong NaCl được hình thành là do:
Na→Na++e;Cl+e→Cl−;Na++Cl−→NaCl
Câu 7: Biết rằng liên kết ion được tạo thành giữa kim loại điển hình và phi kim điển hình. Trong các hợp chất sau đây, hợp chất nào có liên kết ion:
- A
- B
- C
- D
K là kim loại điển hình, Cl là phi kim điển hình.
→ KCl chứa liên kết ion.
Câu 8: Liên kết ion là liên kết hóa học được hình thành bằng lực hút tĩnh điện giữa:
- A
- B
- C
- D
Liên kết ion là liên kết hóa học được hình thành bằng lực hút tĩnh điện giữa các ion mang điện tích trái dấu (cation và anion).
Câu 9: Biết rằng liên kết ion được tạo thành giữa kim loại điển hình và phi kim điển hình. Trong các hợp chất sau đây, hợp chất nào không có liên kết ion:
- A
- B
- C
- D
H là không phải kim loại điển hình, Cl là phi kim điển hình.
→ HCl không chứa liên kết ion.
Câu 10: Chọn phát biểu sai:
- A
- B
- C
- D
Phát biểu sai: Liên kết ion được tạo thành giữa nguyên tử kim loại và nguyên tử phi kim. Vì có trường hợp liên kết giữa nguyên tử kim loại và nguyên tử phi kim không phải liên kết ion, ví dụ như: AlBr3,…
Câu 11: Chọn phát biểu đúng:
- A
- B
- C
- D
Liên kết ion là liên kết hóa học được hình thành bằng lực hút tĩnh điện giữa các ion mang điện tích trái dấu (cation và anion).
Câu 12: Phát biểu nào sau đây không đúng :
- A
- B
- C
- D
Phi kim chỉ có thể tạo được anion thôi