HỢP CHẤT CỦA SẮT
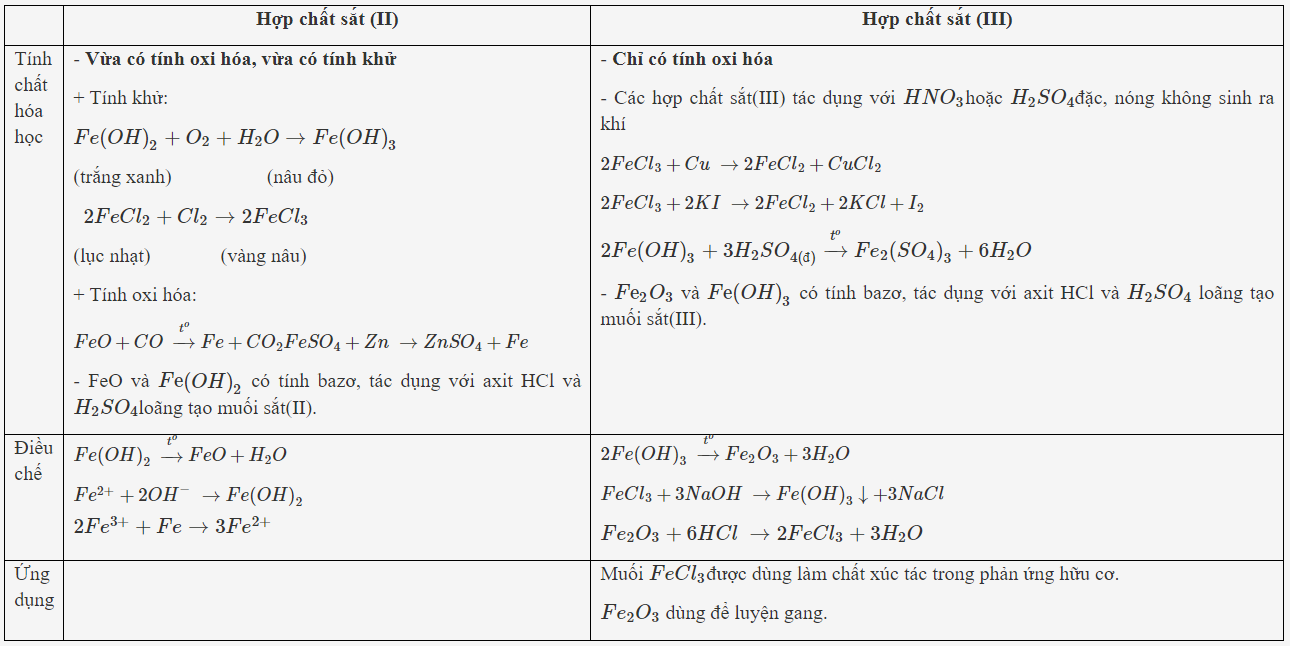
Lý thuyết về HỢP CHẤT CỦA SẮT
HỢP CHẤT CỦA SẮT
Bài tập tự luyện có đáp án
Câu 1: Công thức của sắt(III) oxit là
- A
- B
- C
- D
Công thức của sắt(III) oxit là Fe2O3.Fe2O3.
Câu 2: Hợp chất sắt(II) nitrat có công thức là
- A
- B
- C
- D
Hợp chất sắt(II) nitrat có công thức là Fe(NO3)2.Fe(NO3)2.
Câu 3: Kim loại nào sau đây không tác dụng với dung dịch FeCl3?FeCl3?
- A
- B
- C
- D
Ag không tác dụng với dung dịch FeCl3.FeCl3.
Câu 4: Cách bảo quản muối sắt (II) không bị oxi hóa là
- A
- B
- C
- D
Cho thêm một đinh sắt để muối sắt (II) không bị oxi hóa: Fe+2Fe3+→3Fe2+Fe+2Fe3+→3Fe2+
Câu 5: Cho NH3NH3 dư vào dung dịch chất nào sau đây, thu được kết tủa?
- A
- B
- C
- D
Chất tác dụng với NH3NH3 dư thu được kết tủa là FeSO4.FeSO4. Vì các chất còn lại đều tạo phức tan.
Câu 6: Khi thêm dung dịch Na2CO3Na2CO3 vào dung dịch FeCl3FeCl3 sẽ có hiện tượng gì xảy ra?
- A
- B
- C
- D
Phương trình phản ứng:
2FeCl3+ 3Na2CO3+ 3H2O → 2Fe(OH)3↓+ 3CO2↑ + 6NaCl2FeCl3+ 3Na2CO3+ 3H2O → 2Fe(OH)3↓+ 3CO2↑ + 6NaCl
Câu 7: Nung Fe(NO3)2 trong bình kín, không có không khí, thu được sản phẩm gồm
- A
- B
- C
- D
4Fe(NO3)2toC→2Fe2O3+4NO2+5O24Fe(NO3)2toC−−→2Fe2O3+4NO2+5O2.
Câu 8: Tính chất hóa học chung của muối sắt (III) là tính
- A
- B
- C
- D
Sắt (III) có số oxi hóa cao nhất của sắt nên chỉ có tính oxi hóa
Câu 9: Công thức của sắt (III) nitrat là
- A
- B
- C
- D
Công thức của sắt (III) nitrat là: Fe(NO3)3Fe(NO3)3.
Câu 10: Tính chất hóa học chung của muối sắt (II) là tính
- A
- B
- C
- D
Fe2++2e→FeFe2+→Fe3++e ; Fe2+ có cả tính oxi hóa và tính khử
Câu 11: Chất nào sau đây tác dụng với dung dịch NaOH tạo ra kết tủa màu trắng hơi xanh, dễ hoá nâu trong không khí?
- A
- B
- C
- D
FeCl2+2NaOH→Fe(OH)2+2NaCl
Câu 12: Thành phần chính của quặng pirit là
- A
- B
- C
- D
Thành phần chính của quặng pirit là FeS2.
Câu 13: Nung Mg(OH)2 , FeO và Fe(OH)2 ngoài không khí cho đến khi khối lượng không đổi thu được chất rắn. Thành phần của chất rắn gồm
- A
- B
- C
- D
Mg(OH)2to→MgO+H2O4FeO+O2to→2Fe2O34Fe(OH)2+O2to→2Fe2O3+4H2O
Vậy chất rắn gồm MgO;Fe2O3.
Câu 14: Sắt (II) oxit là chất rắn màu đen. Công thức của sắt(II) oxit là
- A
- B
- C
- D
Công thức của sắt(II) oxit là FeO.
Câu 15: Dung dịch KOH tác dụng với chất nào sau đây tạo ra kết tủa Fe(OH)3?
- A
- B
- C
- D
3KOH+FeCl3→Fe(OH)3+3KCl
Câu 16: Nhiệt phân hoàn toàn Fe(OH)2 trong không khi đến khối lượng không đổi, thu được chất rắn là
- A
- B
- C
- D
4Fe(OH)2+O2to→2Fe2O3+4H2O
Câu 17: Chất nào sau đây khi cho tác dụng với H2SO4 đặc, nóng không có khí thoát ra?
- A
- B
- C
- D
Fe2O3 khi cho tác dụng với H2SO4 đặc, nóng không có khí thoát ra.
Câu 18: Công thức của sắt(III) hiđroxit là
- A
- B
- C
- D
Công thức của sắt(III) hiđroxit là Fe(OH)3.
Câu 19: Hợp chất FeS có tên gọi
- A
- B
- C
- D
Hợp chất FeS có tên gọi: Sắt (II) sunfua.
Câu 20: Dung dịch Fe2(SO4)3 không phản ứng với chất nào sau đây?
- A
- B
- C
- D
Dung dịch Fe2(SO4)3 không phản ứng với Ag.
Câu 21: Công thức hóa học của sắt (III) nitrat là
- A
- B
- C
- D
Công thức hóa học của sắt (III) nitrat là Fe(NO3)3.
Câu 22: Công thức phân tử của sắt (III) oxit là
- A
- B
- C
- D
Công thức phân tử của sắt (III) oxit là Fe2O3.
Câu 23: Trong các hợp chất của sắt sau đây: FeS, FeS2,Fe2O3.FeO , hợp chất nào có hàm lượng sắt lớn nhất?
- A
- B
- C
- D
Hàm lượng của Fe trong FeO là lớn nhất %mFe(FeO)=77,78%.
Câu 24: Nhiệt phân Fe(OH)2 trong không khí đến khối lượng không đổi, thu được chất rắn là
- A
- B
- C
- D
Nhiệt phân Fe(OH)2 trong không khí đến khối lượng không đổi, thu được chất rắn là Fe2O3.
2Fe(OH)2+12O2to→Fe2O3+2H2O.
Câu 25: Cho dung dịch FeCl3 tác dụng với dung dịch NaOH tạo thành kết tủa có màu
- A
- B
- C
- D
FeCl3+3NaOH→Fe(OH)3↓+3NaCl
Kết tủa Fe(OH)3 màu nâu đỏ.
Câu 26: Chất nào sau đây khi cho tác dụng với H2SO4 đặc, nóng không có khí thoát ra?
- A
- B
- C
- D
Fe2O3 khi cho tác dụng với H2SO4 đặc, nóng không có khí thoát ra.
Câu 27: Cho dãy các kim loại sau: Cu, Ni, Zn, Mg, Ba, Ag. Số kim loại trong dãy phản ứng được với dung dịch FeCl3 là
- A
- B
- C
- D
Do tính khử Fe2+>Ag+ nên Ag không phản ứng với FeCl3
các kim loại Cu, Ni, Zn, Mg đều khử được FeCl3 .
Ba tạo kết tủa Fe(OH)3 với dd FeCl3 .
Vậy só kim loại trong dãy phản ứng được với dung dịch FeCl3 là 5.
Câu 28: Điều chế FeCl2 ta có thể dùng cách nào sau đây?
- A
- B
- C
- D
Điều chế muối sắt (II) clorua ta có thể dùng sắt khử muối sắt (III) clorua: 2FeCl3+Fe→3FeCl2
Câu 29: Quặng manhetit là quặng giàu sắt nhất nhưng hiếm có trong tự nhiên. Trong quặng manhetit chứa nhiều hợp chất sắt nào sau đây?
- A
- B
- C
- D
Trong quặng manhetit chứa Fe3O4.
Câu 30: Công thức của oxit sắt từ là
- A
- B
- C
- D
Công thức của oxit sắt từ là Fe3O4.
Câu 31: Tính chất hóa học đặc trưng của hợp chất sắt (II) là
- A
- B
- C
- D
Tính chất hóa học đặc trưng của hợp chất sắt (II) là tính khử.
Xem thêm các bài tiếp theo bên dưới