AMIN I. Khái niệm, phân loại và danh pháp 1. Khái niệm
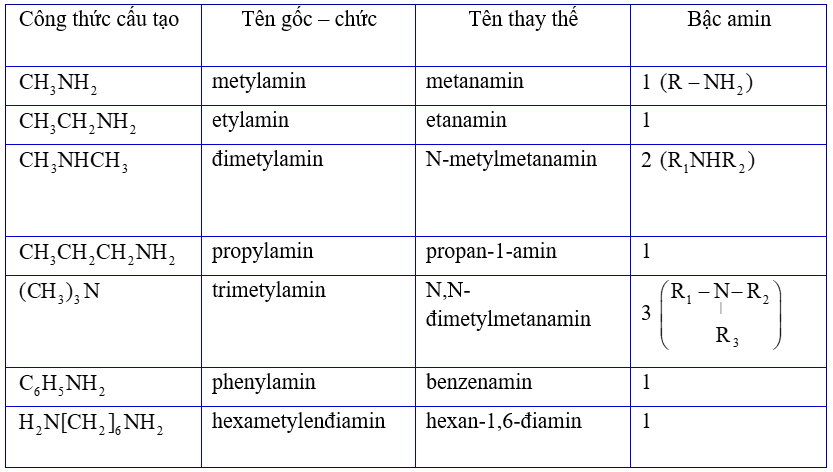
Lý thuyết về AMIN I. Khái niệm, phân loại và danh pháp 1. Khái niệm
AMIN
I. Khái niệm, phân loại và danh pháp
1. Khái niệm
- Khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hiđrocacbon ta thu được amin.
2. Phân loại, danh pháp
- Phân loại theo bậc của amin: Bậc amin được tính bằng số gốc hiđrocacbon liên kết với nguyên tử nitơ.
- Tên của amin:
II. Tính chất vật lí
- Metylamin, đimetylamin, trimetylamin và etylamin là chất khí, mùi khai, tan nhiều trong nước.
- Các amin phân tử khối cao hơn ở thể lỏng hoặc rắn.
- Anilin là chất lỏng ở điều kiện thường, để lâu trong không khí chuyển thành màu đen.
- Các amin đều độc.
III. Tính chất hóa học
Bài tập tự luyện có đáp án
Câu 1: Tên gọi của amin có công thức cấu tạo CH3NHCH2CH3 là
- A
- B
- C
- D
CH3NHCH2CH3 : etylmetylamin.
Câu 2: Cho ba hợp chất butylamin (1), ancol butylic (2) và pentan (3). Thứ tự giảm dần nhiệt độ sôi là
- A
- B
- C
- D
Xét nhiệt độ sôi: ancol > amin > CxHy
Do đó: ancol butylic > butylamin > pentan
Câu 3: Phát biểu nào sau đây đúng khi nói về sự đổi màu của các chất khi gặp quỳ tím?
- A
- B
- C
- D
Phenol, anilin không làm quỳ tím đổi màu.
Etylamin có tính bazơ khá mạnh (mạnh hơn NH3 ) nên trong nước có khả năng làm cho quỳ tím chuyền thành màu xanh.
Dung dịch Natriphenolat làm quỳ tím đổi màu thành màu xanh.
Câu 4: Metylamin (CH3NH2) tác dụng được với chất nào sau đây trong dung dịch?
- A
- B
- C
- D
Metylamin (CH3NH2) tác dụng được với H2SO4.
Câu 5: Metylamin (CH3NH2) tác dụng được với chất nào sau đây trong dung dịch?
- A
- B
- C
- D
Metylamin (CH3NH2) tác dụng được với HCl.
Câu 6: Phát biểu nào sau đây là đúng?
- A
- B
- C
- D
Khi thay thế lần lượt các nguyên tử H trong phân tử NH3 bằng gốc hiđrocacbon, ta thu được amin.
VD: CH3NH2;(CH3)2NH;(CH3)3N.
Câu 7: Chất nào sau đây là amin bậc 2?
- A
- B
- C
- D
Amin bậc 2 là: CH3−NH−CH3.
Câu 8: Chất nào sau đây là amin bậc 2?
- A
- B
- C
- D
Amin bậc 2 là đimetylamin.
Câu 9: Cho các chất có cấu tạo như sau:
(1)CH3−CH2−NH2;(2)CH3−NH−CH3;(3)CH3−CO−NH2;(4)NH2−CO−NH2;(5)NH2−CH2−COOH;(6)C6H5−NH2;(7)C6H5NH3Cl;(8)C6H5−NH−CH3;(9)CH2=CH−NH2.
Số phân tử thuộc loại amin là
- A
- B
- C
- D
Những amin là:
(1)CH3−CH2−NH2;(2)CH3−NH−CH3;(6)C6H5−NH2;(8)C6H5−NH−CH3;(9)CH2=CH−NH2
Câu 10: Chất nào sau đây là amin bậc II?
- A
- B
- C
- D
Amin bậc 2 là đimetylamin.
Câu 11: Khẳng định nào sau đây không đúng?
- A
- B
- C
- D
Amin có CTCT (CH3)2CHNH2 có tên gốc chức là iso-propylamin.
Câu 12: Hợp chất nào sau đây có nhiệt độ sôi cao nhất?
- A
- B
- C
- D
chất có phân tử khối càng lớn nhiệt độ sối càng cao
Chất có cấu tạo càng phân nhánh có nhiệt độ sôi càng thấp.
Do đó butylamin có nhiệt độ sôi cao nhất.
Câu 13: Công thức tổng quát của amin mạch hở có dạng là
- A
- B
- C
- D
Công thức tổng quát của amin mạch hở có a liên kết pi và k nhóm chức amin có dạng là CnH2n+2−2a+kNk.
Câu 14: Tên gọi amin nào sau đây là không đúng?
- A
- B
- C
- D
C6H5NH2 là anilin.
Câu 15: Phát biểu nào sau đây về tính chất vật lý của amin là không đúng?
- A
- B
- C
- D
Anilin là chất lỏng, không màu, rất độc, ít tan trong nước.
Xem thêm các bài tiếp theo bên dưới