Lý thuyết chung về axit sunfuric - muối sunfat
Lý thuyết về Lý thuyết chung về axit sunfuric - muối sunfat
I. Axit sunfuric
1. Tính chất vật lý.
- Axit sunfuric (${{H}_{2}}S{{O}_{4}}$) là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gấp 2 lần nước (${{H}_{2}}S{{O}_{4}}\,98%$ có D = 1,84 $g/c{{m}^{3}}$)
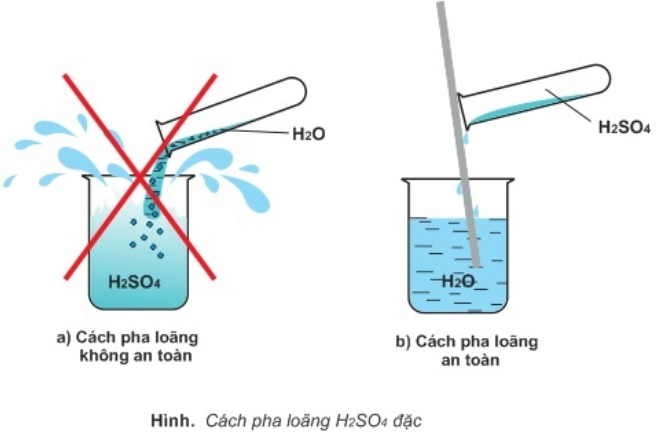
- Các pha loãng axit ${{H}_{2}}S{{O}_{4}}$ đặc
2. Tính chất hóa học
a. Tính chất của dung dịch axit sunfuric loãng
Dung dịch axit ${{H}_{2}}S{{O}_{4}}$ loãng là một axit mạnh, có đầy đủ tính chất của một axit
- Đổi màu quỳ tím thành đỏ
- Tác dụng với kim loại hoạt động, giải phóng khí hiđro
- Tác dụng với oxit bazơ và với bazơ
- Tác dụng được với nhiều muối
b) Tính chất của axit sunfuric đặc
- Tính oxi hóa mạnh
Axit sunfuric đặc, nóng có tính oxi hóa mạnh, nó oxi hóa được hầu hết các kim loại (trừ Au, Pt) nhiều phi kim (C, S, P…) và nhiều hợp chất :
$2{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}\,+\,\overset{0}{\mathop{Cu}}\,\to \overset{+2}{\mathop{Cu}}\,S{{O}_{4}}+2{{H}_{2}}O+\overset{+4}{\mathop{S}}\,{{O}_{2}} \\$
$ 2{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}+\overset{0}{\mathop{S}}\,\to 3\overset{+4}{\mathop{S}}\,{{O}_{2}}+2{{H}_{2}}O \\$
$ 2{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}+2KB{{\text{r}}^{-}}\to \overset{0}{\mathop{B{{\text{r}}_{2}}}}\,+\overset{+4}{\mathop{S}}\,{{O}_{2}}+2{{H}_{2}}O+{{K}_{2}}S{{O}_{4}} \\$
- Tính háo nước :
Axit sunfuric đặc hấp thụ mạnh nước. Nó cũng hấp thụ nước từ các hợp chất gluxit.
VD: ${{H}_{2}}S{{O}_{4}}$ đặc vào đường saccarozơ
${{C}_{12}}{{H}_{22}}{{O}_{11}}\xrightarrow{{{H}_{2}}S{{O}_{4}}\,dac}12C\,+\,11{{H}_{2}}O$
Sau đó một phần cacbon bị ${{H}_{2}}S{{O}_{4}}$
$C+2{{H}_{2}}S{{O}_{4\,dac}}\to C{{O}_{2}}+2S{{O}_{2}}+2{{H}_{2}}O$
Da thịt tiếp xúc với ${{H}_{2}}S{{O}_{4}}$ đặc sẽ bị bỏng rất nặng.
3. Ứng dụng
- Axit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm, các nước trên thế giới sản xuất khoảng 160 triệu tấn ${{H}_{2}}S{{O}_{4}}$
- Axit sunfuric được dùng để sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ.
4. Sản xuất axit sunfuric
Trong công nghiệp.
Có 3 công đoạn chính.
a) Sản xuất lưu huỳnh đioxit $S{{O}_{2}}$
- Đốt cháy lưu huỳnh
$S+{{O}_{2}}\xrightarrow{{{t}^{o}}}S{{O}_{2}}$
- Đốt quặng pirit sắt \[\text{Fe}{{\text{S}}_{2}}\]
$4F\text{e}{{S}_{2}}+11{{\text{O}}_{2}}\xrightarrow{{{t}^{o}}}2F{{\text{e}}_{2}}{{O}_{3}}+8\text{S}{{O}_{2}}$
b) Sản xuất lưu huỳnh trioxit ($S{{O}_{3}}$)
Oxi hóa $S{{O}_{2}}$ bằng khí oxi hoặc không khí dư ở nhiệt độ $450-{{500}^{0}}C$, chất xúc tác là vanadi (V) oxit ${{V}_{2}}{{O}_{5}}$ :
$2{\text{S}}{O_2} + {O_2}\overset {xt,{t^o}} \leftrightarrows 2{\text{S}}{O_3}$
c) Hấp thụ $S{{O}_{3}}$ bằng ${{H}_{2}}S{{O}_{4}}$
Dùng ${{H}_{2}}S{{O}_{4}}$ 98% hấp thụ $S{{O}_{3}}$ , được oleum ${{H}_{2}}S{{O}_{4}}.n\text{S}{{O}_{3}}$
${{H}_{2}}S{{O}_{4}}+n\text{S}{{O}_{3}}\to {{H}_{2}}S{{O}_{4}}.n\text{S}{{O}_{3}}$
Sau đó dùng lượng nước thích hợp pha loãng oleum, được ${{H}_{2}}S{{O}_{4}}$ đặc :
${{H}_{2}}S{{O}_{4}}.n\text{S}{{O}_{3}}+n{{H}_{2}}O\to (n+1){{H}_{2}}S{{O}_{4}}$
II. Muối sunfat. Nhận biết ion sunfat
1. Muối sunfat
Muối sunfat là muối của axit sunfuric. Có 2 loại muối sunfat :
- Muối trung hòa (muối sunfat) chứa ion sunfat $SO_{4}^{2-}$. Phần lớn muối sunfat đều tan trừ $BaS{{O}_{4}}$, $S\text{r}S{{O}_{4}}$, $PbS{{O}_{4}}$ không tan.
- Muối axit (muối hiđrosunfat) chứa ion hiđrosunfat $H\text{S}O_{4}^{-}$ .
2. Nhận biết ion sunfat
Thuốc thử nhận biết ion sunfat $SO_{4}^{2-}$ là dung dịch muối bari. Sản phẩm phản ứng là bari sunfat $BaS{{O}_{4}}$ kết tủa trắng, không tan trong axit.
${{H}_{2}}S{{O}_{4}}+BaC{{l}_{2}}\to BaS{{O}_{4}}\downarrow +2HCl \\$
$N{{a}_{2}}S{{O}_{4}}+BaC{{l}_{2}}\to BaS{{O}_{4}}\downarrow +2NaCl \\$
Bài tập tự luyện có đáp án
Câu 1: Để nhận biết muối sunfat người ta thường dùng dung dịch nào dưới đây ?
- A
- B
- C
- D
Để nhận biết muối sunfat người ta thường dùng $Ba{(OH)_2}$ để thu được kết tủa $BaS{O_4}$ màu trắng, không tan trong axit
$B{a^{2 + }} + SO_4^{2 - } \to BaS{O_4}$
Câu 2: Muối sunfat là muối có chứa ion nào ?
- A
- B
- C
- D
Muối sunfat chứa ion $SO_4^{2 - }$
Câu 3: Chất nào dưới đây lưu huỳnh không có số oxi hóa là +6 ?
- A
- B
- C
- D
Chất không có số oxi hóa +6 là $KH{{\text{S}}^{ + 4}}{O_3}$
Câu 4: Số oxi hóa của lưu huỳnh trong ${H_2}S{O_4}$ là
- A
- B
- C
- D
\[{H_2}\mathop S\limits^{ + 6} {O_4}\]
Câu 5: Cho phương trình phản ứng:
$2Al + 6{H_2}S{O_4}{\,_{dac}}\xrightarrow{{{t^o}}}A{l_2}{\left( {S{O_4}} \right)_3} + {\text{ }}3S{O_2} + 6{\text{ }}{H_2}O$
Số phân tử ${H_2}S{O_4}$ bị khử và số phân tử ${H_2}S{O_4}$ làm môi trường lần lượt là
- A
- B
- C
- D
Số phân tử ${H_2}S{O_4}$ bị khử là 3 , ${H_2}S{O_4}$ làm môi trường là 3.
Câu 6: Trong số những tính chất sau, tính chất nào không là tính chất của axit sunfuric đặc ?
- A
- B
- C
- D
${H_2}S{O_4}$ không phản ứng với kim loại Au, Pt
Câu 7: Phát biểu nào dưới đây không đúng?
- A
- B
- C
- D
Khi pha loãng \[{H_2}S{O_4}\] đặc ta cho từ từ axit vào nước không được đổ nhanh rất nguy hiểm
Câu 8: Cho Fe vào dung dịch \[{H_2}S{O_4}\] đặc, nóng dư, sản phẩm phản ứng là
- A
- B
- C
- D
$2F{\text{e}} + \,6{H_2}S{O_{4\,dac}}\xrightarrow{{{t^o}}}F{{\text{e}}_2}{(S{O_4})_3} + 3S{O_2} + 6{H_2}O$
Câu 9: Khi cho cacbon tác dụng với dung dịch \[{H_2}S{O_4}\] đặc thu được hỗn hợp sản phẩm là
- A
- B
- C
- D
$C + 2{H_2}S{O_{4\,dac}}\xrightarrow{{{t^o}}}C{O_2} + 2S{O_2} + 2{H_2}O\,$
Câu 10: Dãy nào dưới đây chứa các chất đều không tan trong nước?
- A
- B
- C
- D
Dãy chất đều không tan trong nước là: $BaS{O_4},\,S{\text{rS}}{O_4},\,Pb{\text{S}}{O_4}.$
Câu 11: Muối nào dưới đây không tan trong axit ?
- A
- B
- C
- D
Muối không tan trong axit là $BaS{O_4}$
Câu 12: Cách nào sau đây dùng để pha loãng axit \[{H_2}S{O_4}\] đặc?
- A
- B
- C
- D
Do ${H_2}S{O_4}$ đặc hấp thu mạnh nước và tỏa nhiều nhiệt, vì vậy để pha loãng ${H_2}S{O_4}$ đặc người ta đổ từ từ axit vào nước
Câu 13: Dung dịch \[{H_2}S{O_4}\] loãng không tác dụng với chất nào dưới đây?
- A
- B
- C
- D
${H_2}S{O_4}$ loãng không phản ứng với kim loại đứng sau H trong dãy hoạt động kim loại $ \to $ Không phản ứng với Cu
Câu 14: Muối nào dưới đây không tan trong nước ?
- A
- B
- C
- D
Muối không tan trong nước là : $B{\text{aS}}{O_4}$
Câu 15: Dung dịch \[{H_2}S{O_4}\]loãng không tác dụng với kim loại nào dưới đây?
- A
- B
- C
- D
${H_2}S{O_4}$ loãng không phản ứng trực tiếp với kim loại đứng sau H trong dãy hoạt động
$ \to $ không phản ứng với Ag.
Câu 16: Công thức của oleum là
- A
- B
- C
- D
Công thức của oleum là ${H_2}S{O_4}.n{\text{S}}{O_3}.$
Câu 17: Số oxi hóa của lưu huỳnh trong một loại oleum \[{H_2}{S_2}{O_7}\] là
- A
- B
- C
- D
Số oxi hóa của S trong \[{H_2}{S_2}{O_7}\]: là + 6
Câu 18: \[{H_2}S{O_4}\] đặc không thể hiện tính oxi hóa khi phản ứng với chất nào dưới đây?
- A
- B
- C
- D
${H_2}S{O_4}$ đặc thể hiện tính axit khi phản ứng với $F{{\text{e}}_2}{O_3}$ (do ở hợp chất này Fe có số oxi hóa cao nhất là + 3)
$3{H_2}S{O_4} + F{{\text{e}}_2}{O_3} \to F{{\text{e}}_2}{(S{O_4})_3} + 3{H_2}O$
Câu 19: Muối nào dưới đây là kết tủa màu trắng ?
- A
- B
- C
- D
$BaS{O_4}$ có kết tủa trắng
Câu 20: Khi cho lưu huỳnh tác dụng với dung dịch \[{H_2}S{O_4}\]đặc nóng thường thu được chất nào dưới đây?
- A
- B
- C
- D
$S\, + \,2{H_2}S{O_{4\,dac}}\xrightarrow{{{t^o}}}3S{O_2} + 2{H_2}O$
Câu 21: Axit sunfuric đặc thể hiện tính oxi hóa mạnh trong phản ứng với chất nào dưới đây?
- A
- B
- C
- D
${H_2}S{O_4}$ đặc thể hiện tính oxi hóa khi phản ứng với chất khử mạnh :$F{\text{eC}}{{\text{l}}_2}$ (do Fe đang ở trang thái oxi hóa là +2)
Câu 22: Cho phương trình hóa học : ${H_2}S{O_4} + 8HI \to 4{I_2} + {H_2}S + 4{H_2}O$
Câu nào sau đây diễn tả không đúng tính chất của các chất ?
${H_2}S{O_4} + 8HI \to 4{I_2} + {H_2}S + 4{H_2}O$
Câu nào sau đây diễn tả không đúng tính chất của các chất ?
- A
- B
- C
- D
Phát biểu sai là : ${I_2}$ oxi hóa ${H_2}S$ thành ${H_2}S{O_4}$ và nó bị khử thành HI
Câu 23: Muối nào dưới đây không bị phân hủy ở nhiệt độ cao ?
- A
- B
- C
- D
Muối không bị phân hủy ở nhiệt độ cao là : \[BaS{O_4}\]
Câu 24: Trong quá trình điều chế ${H_2}S{O_4}$ trong công nghiệp, người ta thường hấp thụ \[S{O_3}\] bằng
- A
- B
- C
- D
Quy trình điều chế axit ${H_2}S{O_4}$ đặc trong công nghiệp là :
$F{\text{e}}{S_2}\xrightarrow{{ + {O_2}}}S{O_2}\xrightarrow{{ + {O_2}}}S{O_3}\xrightarrow{{ + {H_2}S{O_4}\,dac}}{H_2}S{O_4}.n{\text{S}}{O_3}\xrightarrow{{ + {H_2}O}}{H_2}S{O_4}\,dac$
Câu 25: Cho dung dịch \[{H_2}S{O_4}\] tới dư vào \[BaC{O_3}\], thấy hiện tượng
- A
- B
- C
- D
$BaC{{\text{O}}_3} + {H_2}S{O_4} \to BaS{O_4} + C{O_2} + {H_2}O$
$ \to $ có kết tủa trắng và có khí không màu
Câu 26: Chất tác dụng được với \[{H_2}S{O_4}\] đặc nóng nhưng không tan trong \[{H_2}S{O_4}\] loãng là
- A
- B
- C
- D
Cu phản ứng với ${H_2}S{O_4}$ đặc, nóng nhưng không phản ứng với ${H_2}S{O_4}$ loãng
\[Cu{\text{ }} + {\text{ }}2{H_2}S{O_4}{\text{dac }}\xrightarrow{{{t^o}}}CuS{O_4} + {\text{ }}S{O_2} + {\text{ }}2{H_2}O\]
Câu 27: Muối hiđrosunfat là muối có chứa ion nào dưới đây ?
- A
- B
- C
- D
Muối hiđrosunfat là muối có chứa ion $H{\text{S}}O_4^ - $
Câu 28: ${V_2}{O_5}$ (vanađi (V) oxit ) là xúc tác của phản ứng nào dưới đây ?$$
- A
- B
- C
- D
$2S{O_2} + {O_2}\overset {{V_2}{O_5},\,{t^o}} \leftrightarrows 2S{O_3}$
Câu 29: ${H_2}S{O_4}$ loãng phản ứng với dãy chất nào dưới đây thu được kết tủa ?
- A
- B
- C
- D
${H_2}S{O_4} + Sr{(OH)_2} \to S{\text{r}}S{O_4}{ \downarrow _{trang}}\, + \,2{H_2}O$
Câu 30: Dung dịch axit sunfuhiđric loãng tác dụng được với chất nào dưới đây?
- A
- B
- C
- D
${H_2}S{O_4}$ loãng phản ứng được với KOH
$2KOH + {H_2}S{O_4} \to {K_2}S{O_4} + 2{H_2}O$
Câu 31: Nguyên liệu ban đầu dùng để sản xuất axit sunfuric trong công nghiệp là
- A
- B
- C
- D
Người ta điều chế $S{O_2}$ trong công nghiệp theo sơ đồ sau :
$F{\text{e}}{S_2}\xrightarrow{{ + {O_2}}}S{O_2}\xrightarrow{{ + {O_2}}}S{O_3}\xrightarrow{{ + {H_2}S{O_4}\,dac}}{H_2}S{O_4}.n{\text{S}}{O_3}\xrightarrow{{ + {H_2}O}}{H_2}S{O_4}\,dac$
\[ \to \] Nguyên liệu ban đầu để sản xuất axit sunfuric trong công nghiệp là \[Fe{S_2}\]
Câu 32: Khi cho $FeC{O_3}$ tác dụng với ${H_2}S{O_4}$ đặc nóng dư, sản phẩm khí thu được là
- A
- B
- C
- D
$2F{\text{e}}C{{\text{O}}_3} + 4{H_2}S{O_4} \to F{{\text{e}}_2}{(S{O_4})_3} + 2C{O_2} + S{O_2} + 4{H_2}O$
Câu 33: Axit nào dưới đây rất háo nước ?
- A
- B
- C
- D
${H_2}S{O_4}$ đặc là axit háo nước, tan vô hạn trong nước và tỏa rất nhiều nhiệt.