DÃY ĐIỆN HÓA CỦA KIM LOẠI 1. Cặp oxi hóa – khử của
Lý thuyết về DÃY ĐIỆN HÓA CỦA KIM LOẠI 1. Cặp oxi hóa – khử của
DÃY ĐIỆN HÓA CỦA KIM LOẠI
1. Cặp oxi hóa – khử của kim loại
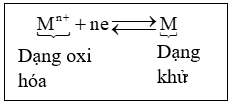
Cặp gồm dạng oxi hoá và dạng khử của cùng 1 nguyên tố được gọi là cặp oxh/khử
Ví dụ: cặp oxi hóa – khử $F{{e}^{2+}}/Fe$
$F{{e}^{2+}}\,\,\,+\,\,\,2e\,\,\,\,\,\,\rightleftarrows \,\,\,\,\,\,\,\,Fe$
dạng oxi hóa dạng khử
2. Dãy điện hóa của kim loại
Dãy điện hóa của kim loại là dãy những cặp oxi hóa – khử của kim loại được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim loại.
3. Ý nghĩa dãy điện hóa của kim loại
a. So sánh tính oxi hóa – khử
- Từ trái sang phải, tính khử của kim loại giảm, tính oxi hóa của cation tăng.
Ví dụ: tính khử của Cu yếu hơn Fe, tính oxi hóa của ion $C{{u}^{2+}}$mạnh hơn $F{{e}^{2+}}$
b. Xác định chiều của phản ứng oxi hóa – khử
Quy tắc α: Phản ứng oxi hóa – khử xảy ra theo chiều:
chất oxi hóa mạnh + chất khử mạnh Š chất oxi hóa yếu + chất khử yếu.
Ví dụ: theo dãy điện hóa, cặp $C{{u}^{2+}}/Cu$đứng trước cặp $A{{g}^{+}}/Ag$
phản ứng xảy ra theo chiều mũi tên, tức là:
$\,\,\,\,\,\,\,\,\,\,\,\,\,\text{Cu}\,\,\,\,\,\,\,\,\text{+}\,\,\,\,\,\,\,\,\,\,\,\,\,\text{2A}{{\text{g}}^{\text{+}\,}}\,\,\,\,\,\,\,\,\,\,\,\,\to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\text{C}{{\text{u}}^{\text{2+}}}\,\,\,\,\,\,\,\,\,\,\,\,\text{+}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\text{2Ag}$
Khử mạnh Oxh mạnh Oxh yếu Khử yếu
c. Xác định thứ tự phản ứng
- Khi cho hỗn hợp kim loại phản ứng với dung dịch hỗn hợp các cation thì phản ứng xảy ra theo thứ tự kim loại mạnh nhất (tính khử mạnh nhất) + muối có tính oxi hóa mạnh nhất trước.
Ví dụ: cho hỗn hợp kim loại Fe và Al vào dung dịch chứa $Cu{{(N{{O}_{3}})}_{2}}$và $AgN{{O}_{3}}$thì thứ tự phản ứng sẽ là kim loại có tính khử mạnh hơn tác dụng với ion kim loại có tính oxi hóa mạnh hơn: $Al+3AgN{{O}_{3}}\to Al{{(N{{O}_{3}})}_{3}}+3Ag$
Nếu hết cả Al và $AgN{{O}_{3}}$ thì xảy ra phản ứng: $Fe+Cu{{(N{{O}_{3}})}_{2}}\to Fe{{(N{{O}_{3}})}_{2}}+Cu$
Bài tập tự luyện có đáp án
Câu 1: Kim loại nào sau đây không tác dụng với dung dịch $ CuC{{l}_{2}}? $
- A
- B
- C
- D
Ag không tác dụng với dung dịch $ CuC{{l}_{2}}. $
Câu 2: Kim loại nào sau đây có tính khử yếu nhất?
- A
- B
- C
- D
Kim loại có tính khử yếu nhất là Ag.
Câu 3: Kim loại nào sau đây có tính khử mạnh nhất?
- A
- B
- C
- D
Kim loại có tính khử mạnh nhất là Mg.
Câu 4: Cặp chất nào sau đây không xảy ra phản ứng?
- A
- B
- C
- D
Cặp chất không xảy ra phản ứng là: $ Ag+Cu{{\left( N{{O}_{3}} \right)}_{2}}. $
Câu 5: Cho các kim loại sau: Al, Mg, Fe. Cu. Kim loại có tính khử mạnh nhất là
- A
- B
- C
- D
Trong bốn kim loại: Al, Mg, Fe. Cu, kim loại có tính khử mạnh nhất là Mg.
Câu 6: Kim loại nào sau đây tan được trong nước ở nhiệt độ thường?
- A
- B
- C
- D
Kim loại tan được trong nước ở nhiệt độ thường là Na.
Câu 7: Cho dãy kim loại Zn, Fe, Cr. Thứ tự giảm dần tính khử của kim loại từ trái sang phải trong dãy là
- A
- B
- C
- D
Thứ tự giảm dần tính khử của kim loại từ trái sang phải trong dãy là: Zn, Cr, Fe.
Câu 8: Trong các kim loại Mg, Cu, Fe, Ag. Kim loại có tính khử mạnh nhất là
- A
- B
- C
- D
Kim loại có tính khử mạnh nhất là Mg.
Câu 9: Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường?
- A
- B
- C
- D
Na tan hết trong nước dư ở nhiệt độ thường.
Câu 10: Ion kim loại nào sau đây có tính oxi hóa mạnh nhất?
- A
- B
- C
- D
$ A{{g}^{+}} $ là ion có tính oxi hóa mạnh nhất.
Câu 11: Cho dãy các kim loại: Al, Mg, Fe và Cu. Kim loại có tính khử mạnh nhất trong dãy là
- A
- B
- C
- D
Kim loại có tính khử mạnh nhất trong dãy là Mg.
Câu 12: Kim loại nào sau đây có tính khử yếu nhất?
- A
- B
- C
- D
Ag là kim loại có tính khử yếu nhất.
Câu 13: Kim loại nào sau đây tan được trong nước ở nhiệt độ thường?
- A
- B
- C
- D
Kim loại tan được trong nước ở nhiệt độ thường là Na.
Câu 14: Trong các kim loại sau đây, kim loại có tính khử yếu nhất là
- A
- B
- C
- D
Kim loại có tính khử yếu nhất là Ag.
Câu 15: Dãy cation kim loại được xếp theo chiều tăng dần tính oxi hoá từ trái sang phải là
- A
- B
- C
- D
Dãy cation kim loại được xếp theo chiều tăng dần tính oxi hoá từ trái sang phải là: $ M{{g}^{2+}},F{{e}^{2+}},C{{u}^{2+}}. $
Câu 16: Kim loại nào sau đây có tính khử mạnh nhất?
- A
- B
- C
- D
Kim loại có tính khử mạnh nhất là K.
Câu 17: Cho dãy kim loại Zn, Fe, Cr. Thứ tự giảm dần độ hoạt động hóa học của kim loại từ trái sang phải trong dãy là
- A
- B
- C
- D
Thứ tự giảm dần độ hoạt động hóa học của kim loại từ trái sang phải trong dãy là: Zn, Cr, Fe.