Khái niệm và phân loại liên kết cộng hóa trị
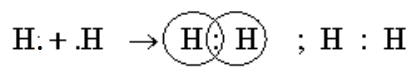
Lý thuyết về Khái niệm và phân loại liên kết cộng hóa trị
Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung
1. Sự hình thành đơn chất.
a) Sự hình thành phân tử hiđro (${{H}_{2}}$)
H (Z = 1) cấu hình electron $1{{\text{s}}^{1}}$, hai nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành một cặp electron chung trong phân tử ${{H}_{2}}$
Dấu “:” được thay bằng 1 gạch H – H gọi là công thức cấu tạo, giữa 2 nguyên tử hiđro có 1 cặp electron liên kết biểu thị bằng (-) đó là liên hết đơn.
b) Sự hình thành phân tử nitơ (${{N}_{2}}$)
Cấu hình electron của N (Z = 7) $1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{p}^{3}}$ có 5 electron ở lớp ngoài cùng, trong phân tử ${{N}_{2}}$ để đạt cấu hình electron của nguyên tử khí hiếm gần nhất (Ne), mỗi nguyên tử nitơ phải góp chung 3 electron.
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng ba gạch ($\equiv $), đó là liên kết ba
2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất
a) Sự hình thành phân tử hiđro clorua (HCl)
H $(1{{\text{s}}^{1}})$, Cl $(1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{p}^{6}}3{{\text{s}}^{2}}3{{p}^{5}}$. Mỗi nguyên tử H và Cl góp 1 electron tạo thành 1 cặp electron chung tạo nên một liên kết cộng hóa trị. Độ âm điện của Cl lớn hơn nên cặp e chung bị lệch về phái Cl
Chú ý: Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết công hóa trị phân cực
b) Sự hình thành phân tử khí cacbon đioxit ($C{{O}_{2}}$) (có cấu tạo thằng)
Cấu hình electron của C (Z = 6): $1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{p}^{2}}$ thiếu 4 electron để đạt cấu hình bền vững
Cấu hình electron của O (Z = 8) : $1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{p}^{4}}$ thiếu 2 electron để đạt cấu hình bền vững
Liên kết giữa nguyên tử C và O phân cực, nhưng phân tử $C{{O}_{2}}$ không bị phân cực
Bài tập tự luyện có đáp án
Câu 1: Liên kết hóa học trong phân tử flo, clo, brom, iot, oxi đều là:
- A
- B
- C
- D
Các phân tử: $ {{F}_{2}},C{{l}_{2}},B{{r}_{2}},{{O}_{2}} $ tạo nên từ hai nguyên tử của cùng 1 nguyên tố (có độ âm điện như nhau) các cặp electron dùng chung không bị hút lệch về phía nguyên tử nào $ \to $
liên kết cộng hóa trị không phân cực.
Câu 2: Trong các hợp chất sau đây, hợp chất nào có liên kết cộng hóa trị:
- A
- B
- C
- D
$ LiCl,NaF,Ca{{F}_{2}} $ đều tạo từ kim loại điển hình và phi kim điển hình $ \to $ chúng đều được tạo nên nhờ liên kết ion.
$ \to $ Hợp chất có liên kết cộng hóa trị: $ CC{{l}_{4}} $
Câu 3: Liên kết cộng hóa trị trong phân tử HCl có đặc điểm
- A
- B
- C
- D
Liên kết cộng hóa trị trong phân tử HCl (H –Cl) có đặc điểm có một cặp electron chung, là liên kết đơn, phân cực.
Câu 4: Biết độ âm điện của $ F > Cl > Br > I $ , mức độ phân cực của liên kết hoá học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là:
- A
- B
- C
- D
Vì các phân tử đều có nguyên tử H nên độ phân cực giảm khi độ âm điện của các nguyên tố giảm.
$ \to $ Chọn HCl , HBr, HI.
Câu 5: Phân tử $ N{{H}_{3}} $ có số cặp electron dùng chung là
- A
- B
- C
- D
Phân tử $ N{{H}_{3}} $ : $ \begin{array}{l} & H-\underset{\left| {} \right.}{\mathop{N}}\,-H \\ & \,\,\,\,\,\,\,\,H \end{array} $ có 3 cặp electron dùng chung.
Câu 6: Liên kết ion là liên kết được hình thành giữa hai nguyên tố có hiệu độ âm điện $ (\Delta \chi ) $ nằm trong khoảng
- A
- B
- C
- D
Liên kết ion là liên kết được hình thành giữa hai nguyên tử có hiệu độ âm điện $ \Delta \chi \ge 1,7 $
Câu 7: Phân tử $ {{H}_{2}}S $ có số cặp electron dùng chung là
- A
- B
- C
- D
Phân tử $ {{H}_{2}}S $ : H –S –H
có 2 cặp electron dùng chung.
Câu 8: Khí hiđroclorua tan tốt trong nước vì :
- A
- B
- C
- D
HCl có liên kết cộng hóa trị phân cực, phân tử HCl phân cực nên khí hiđroclorua tan tốt trong nước .
Câu 9: Liên kết cộng hóa trị là liên kết:
- A
- B
- C
- D
Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
Câu 10: Liên kết nào có thể được coi là trường hợp riêng của liên kết cộng hoá trị ?
- A
- B
- C
- D
Liên kết ion có thể được coi là trường hợp riêng của liên kết cộng hoá trị.
Câu 11: Liên kết cộng hóa trị tồn tại nhờ:
- A
- B
- C
- D
Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
Câu 12: Iot tan tốt trong dung môi không phân cực vì :
- A
- B
- C
- D
$ {{I}_{2}} $ có liên kết cộng hóa trị không phân cực, phân tử $ {{I}_{2}} $ không phân cực nên $ {{I}_{2}} $ tan tốt trong dung môi không phân cực.
Câu 13: Phân tử $ C{{O}_{2}} $ có số cặp electron dùng chung là
- A
- B
- C
- D
Phân tử $ C{{O}_{2}} $ : $ O=C=O $ có 4 cặp electron dùng chung.
Câu 14: Chọn phát biểu sai trong các câu sau :
- A
- B
- C
- D
Phátbiểu sai: Liên kết cộng hoá trị được tạo thành giữa nguyên tố kim loại điển hình và phi kim điển hình.
Đúng phải là: Liên kết ion được tạo thành giữa nguyên tố kim loại điển hình và phi kim điển hình.
Câu 15: Trong liên kết giữa hai nguyên tử, nếu cặp electron chung chuyển hẳn về một nguyên tử, ta sẽ có liên kết
- A
- B
- C
- D
Trong liên kết giữa hai nguyên tử, nếu cặp electron chung chuyển hẳn về một nguyên tử, ta sẽ có liên kết ion.
Câu 16: Tuỳ thuộc vào số cặp electron dùng chung tham gia tạo thành liên kết cộng hóa trị giữa 2 nguyên tử mà liên kết được gọi là:
- A
- B
- C
- D
Tuỳ thuộc vào số cặp electron dùng chung tham gia tạo thành liên kết cộng hóa trị giữa 2 nguyên tử mà liên kết được gọi là: liên kết ba, liên kết đơn, liên kết đôi.
Ví dụ:
Phân tử $ {{H}_{2}} $ : H – H $ \to $ liên kết đơn
Phân tử $ {{N}_{2}} $ : N $ \equiv $ N $ \to $ liên kết ba
Liên kết đôi: $ C{{H}_{2}}=C{{H}_{2}} $ $ \to $ Liên kết đôi
Câu 17: Khi các nguyên tử liên kết với nhau để tạo thành phân tử thì dù liên kết theo loại nào vẫn phải tuân theo quy tắc:
- A
- B
- C
- D
Nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đat được cấu hình electron bền vững bền của các khí hiếm với 8 electron (hoặc 2 đối với heli ) ở lớp ngoài cùng.
Câu 18: Liên kết trong phân tử tạo bởi hai nguyên tử của cùng một nguyên tố thuộc loại liên kết
- A
- B
- C
- D
Liên kết trong phân tử tạo bởi hai nguyên tử của một nguyên tố thuộc loại liên kết cộng hoá trị không phân cực.
Câu 19: Hoàn thành nội dung sau : "Nói chung, các chất chỉ có ……………..
không dẫn điện ở mọi trạng thái".
- A
- B
- C
- D
Nói chung, các chất chỉ có liên kết cộng hoá trị không có cực (lưu huỳnh, iot, …) không dẫn điện ở mọi trạng thái.
Câu 20: Phân tử chứa liên kết cộng hoá trị phân cực nếu cặp electron chung của liên kết
- A
- B
- C
- D
Phân tử chứa liên kết cộng hoá trị phân cực nếu cặp electron chung của liên kết lệch về phía một nguyên tử.
Câu 21: Trong phân tử nitơ, các nguyên tử liên kết với nhau bằng liên kết
- A
- B
- C
- D
Phân tử $ {{N}_{2}} $ tạo nên từ hai nguyên tử của cùng một nguyên tố (có độ ẩm điện bằng nhau ), nên các cặp electron chung không bị hút lệch về phía nào. Do đó liên kết trong phân tử $ {{N}_{2}} $ không bị phân cực, đó là liên kết cộng hóa trị không cực.
Câu 22: Phát biểu nào sau đây sai khi nói về liên kết trong phân tử HCl ?
- A
- B
- C
- D
Phát biểu sai khi nói về liên kết trong phân tử HCl:
Cặp electron chung của hidro và clo nằm giữa 2 nguyên tử.
Đúng phải là: Cặp electron chung của hidro và clo lệch về phía nguyên tử Cl.