Hợp chất $ A{{l}_{2}}{{O}_{3}} $ không tan được trong dung d
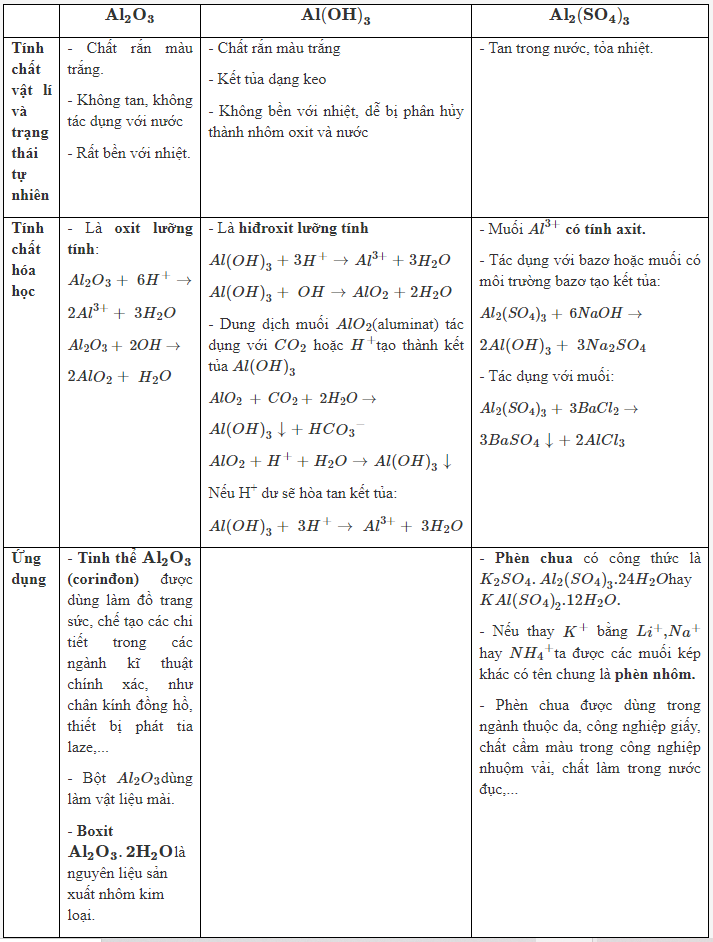
Lý thuyết về Hợp chất $ A{{l}_{2}}{{O}_{3}} $ không tan được trong dung d
Bài tập tự luyện có đáp án
Câu 1: Hợp chất $ A{{l}_{2}}{{O}_{3}} $ không tan được trong dung dịch nào dưới đây?
- A
- B
- C
- D
$ A{{l}_{2}}{{O}_{3}} $ không tan được trong dung dịch \[NaCl\].
Câu 2: $ A{{l}_{2}}{{O}_{3}} $ tan được trong dung dịch nào sau đây?
- A
- B
- C
- D
$ A{{l}_{2}}{{O}_{3}} $ tan được trong dung dịch $ NaOH. $
Câu 3: Công thức của nhôm clorua là
- A
- B
- C
- D
Công thức của nhôm clorua là $ AlC{{l}_{3}}. $
Câu 4: Hiđroxit nào sau đây là chất lưỡng tính?
- A
- B
- C
- D
$ Al{{\left( OH \right)}_{3}} $ là chất lưỡng tính.
Câu 5: Hợp chất nào dưới đây vừa tan được trong dung dịch axit vừa tan được trong dung dịch bazơ?
- A
- B
- C
- D
$ Al{{(OH)}_{3}} $ vừa tan được trong dung dịch axit vừa tan được trong dung dịch bazơ
$ Al{{(OH)}_{3}}+3HCl\to AlC{{l}_{3}}+3{{H}_{2}}O $
$ Al{{(OH)}_{3}}+NaOH\to N\text{aAl}{{\text{O}}_{2}}+2{{H}_{2}}O $
Câu 6: Hợp chất $ Al{{\left( OH \right)}_{3}} $ tan được trong dung dịch
- A
- B
- C
- D
Hợp chất $ Al{{\left( OH \right)}_{3}} $ tan được trong dung dịch NaOH.
Câu 7: Chất nào sau đây có tính lưỡng tính?
- A
- B
- C
- D
Chất có tính lưỡng tính là $ NaHC{{O}_{3}} $
Câu 8: Saphia là một loại ngọc quý trong tự nhiên có thành phần chính là $A{l_2}{O_3}$ lẫn các tạp chất là
- A
- B
- C
- D
Saphia gồm \[A{l_2}{O_3}\] lẫn các tạp chất là \[F{e^{2 + }},\,F{e^{3 + }}\] và \[T{i^{4 + }}\]
Câu 9: Thành phần chính của quặng boxit là
- A
- B
- C
- D
Thành phần chính của quặng boxit là $ A{{l}_{2}}{{O}_{3}}. $
Câu 10: Để xử lý chất thải có tính axit, người ta thường dùng
- A
- B
- C
- D
Để xử lý chất thải có tính axit, người ta thường dùng nước vôi trong.
Câu 11: Công thức hóa học của phèn chua là
- A
- B
- C
- D
Công thức hóa học của phèn chua là $ {{K}_{2}}S{{O}_{4}}.A{{l}_{2}}{{\left( S{{O}_{4}} \right)}_{3}}.24{{H}_{2}}O. $
Câu 12: Công thức của nhôm clorua là
- A
- B
- C
- D
Công thức của nhôm clorua là $ AlC{{l}_{3}}.~ $
Câu 13: Chất nào sau đây không có tính lưỡng tính?
- A
- B
- C
- D
Chất không có tính lưỡng tính là Al.
Câu 14: Dung dịch chất nào sau đây hòa tan được $ A{{l}_{2}}{{O}_{3}} $ ?
- A
- B
- C
- D
Dung dịch \[KOH.\] hòa tan được $ A{{l}_{2}}{{O}_{3}} $
Câu 15: Công thức của nhôm sunfat là
- A
- B
- C
- D
Công thức của nhôm sunfat là $ A{{l}_{2}}{{\left( S{{O}_{4}} \right)}_{3}}.~~~~~~ $
Câu 16: Chất nào sau đây có tính lưỡng tính?
- A
- B
- C
- D
$ Al{{\left( OH \right)}_{3}} $ có tính lưỡng tính.
Câu 17: Công thức hóa học của nhôm brommua là
- A
- B
- C
- D
Công thức hóa học của nhôm brommua là $ AlB{{r}_{3}}. $
Câu 18: Phèn chua là chất được sử dụng nhiều trong công nghiệp thuộc da, chất cầm màu trong công nghiệp nhuộm. Ngoài ra, phèn chua còn được dùng để làm sạch nước ở các vùng ngập lụt. Công thức của phèn chua là
- A
- B
- C
- D
Công thức của phèn chua là $ {{K}_{2}}S{{O}_{4}}.A{{l}_{2}}{{(S{{O}_{4}})}_{3}}.24{{H}_{2}}O. $
Câu 19: Phát biểu nào dưới đây là đúng?
- A
- B
- C
- D
$ Al{{(OH)}_{3}} $ kém bền với nhiệt
$ 2Al{{(OH)}_{3}}\xrightarrow{{{t}^{o}}}A{{l}_{2}}{{O}_{3}}+3{{H}_{2}}O $
Câu 20: Thành phần chính của phèn chua có chứa muối
- A
- B
- C
- D
Thành phần chính của phèn chua có chứa muối $ A{{l}_{2}}{{\left( S{{O}_{4}} \right)}_{3}}. $