Sục từ từ đến dư $\Large CO_{2}$ vào một cốc đựng dung dịch $\Large Ca
MỤC LỤC
Câu hỏi:
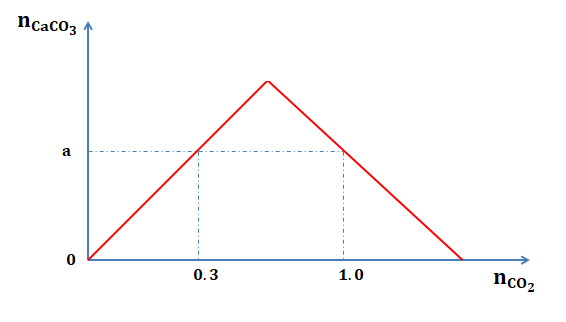
Sục từ từ đến dư $\Large CO_{2}$ vào một cốc đựng dung dịch $\Large Ca(OH)_{2}$. Kết quả thí nghiệm được biểu diễn trên đồ thị như hình bên. Khi lượng $\Large CO_{2}$ đã sục vào dung dịch là 0,85 mol thì lượng kết quả đã xuất hiện là m gam. Giá trị của m là:

Đáp án án đúng là: C
Lời giải chi tiết:
Từ đồ thị $\Large\Rightarrow a = 0,3$ mol
Tại thời điểm $\Large n_{CO_2} = 1$ mol vẫn còn $\Large n_{CaCO_3}=0,3$ mol
$\Large\Rightarrow$ BTNT C: $\Large n_{Ca(HCO_3)_2}= \dfrac{1-0,3}{2}= 0,35$
$\Large\Rightarrow \sum n_{Ca(OH)_2}=0,3+0,35=0,65$
Nếu sục 0,85 mol $\Large CO_2$ vào 0,65 mol $\Large Ca(OH)_2$
$\Large\Rightarrow n_{CaCO_3} = \sum n_{OH^-} - n_{CO_2}$
$\Large =0,65.2-0,85=0,45$
$\Large\Rightarrow m_{CaCO_3}=0,45.100=45$ g
Xem thêm các bài tiếp theo bên dưới
- Cho 86,3 gam hỗn hợp $\Large X$ gồm $\Large Na$, $\Large K$, $\Large B
- Hòa tan hết 0,54g $\Large Al$ trong dung dịch $\Large NaOH$ dư, sau ph
- Nhiệt phân hoàn toàn 100 gam mẫu đá vôi thu được 20,37 lít khí $\Large
- Cho m gam hỗn hợp $\Large X$ gồm $\Large Mg$ và $\Large Al$ vào dung d
- Nung nóng m gam hỗn hợp $\Large Al$ và $\Large Fe_{2}O_{3}$ (trong môi