Oxi hóa 11,7 gam hỗn hợp E gồm 2 ancol bậc một X và Y (đều no, đơn chứ

MỤC LỤC
Câu hỏi:
Oxi hóa 11,7 gam hỗn hợp E gồm 2 ancol bậc một X và Y (đều no, đơn chức, mạch hở, $M_X < M_Y$) bằng oxi (xúc tác thích hợp, nung nóng) thì có 0,09 mol $O_2$ phản ứng, thu được hỗn hợp hơi T (không chứa $CO_2$). Chia T thành 2 phần bằng nhau:
- Phần 1 phản ứng với dung dịch $NaHCO_3$ dư, thu được 0,672 lít khí $CO_2$ (đktc)
- Phần 2 phản ứng với $Na$ dư, thu được 2,016 lít khí $H_2$ (đktc). Biết Y chiếm 25% về số mol hỗn hợp ancol dư trong T và số mol Y bị oxi hóa lớn hơn số mol X bị oxi hóa. Khối lượng của Y trong 11,7 gam E ban đầu là
Đáp án án đúng là: B
Lời giải chi tiết:
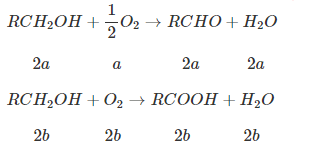
$\large\Rightarrow n_{O_2} = a + 2b = 0,09$ (1)
Trong mỗi phần T chứa $\large RCHO$ (a mol), $\large RCOOH$ (b mol), $\large H_2O$ (a + b) mol và ancol dư (x mol)
Phần 1: $\large n_{RCOOH}=b=n_{CO_2}=0,03$ (2)
Từ (1) và (2) $\large \Rightarrow a = 0,03$
Phần 2: $\large n_{H_2}=\dfrac{b}{2}+\dfrac{a+b}{2} +\dfrac{x}{2}=0,09$
$\large \Rightarrow x = 0,09$
Vậy: $\large n_{RCH_2OH \ ban \ đầu} = 2a + 2b + 2x = 0,3$
$\large \Rightarrow M=\dfrac{11,7}{0,3}=39 \Rightarrow$ X là $\large CH_3OH$
$\large n_{ancol \ pư} = 2a + 2b = 0,12$ mol
Và $\large n_{ancol \ dư} = 2x = 0,18$
Do Y chiếm 25% số mol ancol dư $\large \Rightarrow n_{Y \ dư} = 25\%.2x = 0,045$
$\large n_{X \ dư} = 75\%.2x = 0,135$ mol
Do $\large n_{Y \ pư} > n_{X \ pư} \Rightarrow n_{X \ pư} < 0,06 < n_{Y \ pư}$
$\large \Rightarrow n_{X \ ban \ đầu} < 0,135 + 0,06 = 0,195$
và $\large n_{Y \ ban \ đầu} > 0,045 + 0,06 = 0,105$
Xét biểu thức: $\large 32.n_X + M_Y.n_Y$
Do $\large M_Y > 32$ nên khi $\large n_X$ tăng, $\large n_Y$ giảm thì giá trị biểu thức sẽ giảm (lưu ý lượng tăng, giảm bằng nhau do tổng không đổi)
$\large \Rightarrow m = 0,195.32 + 0,105.M_Y < 11,7$
$\large \Leftrightarrow M_Y < 52$
$\large \Rightarrow M_Y = 46 \Rightarrow$ Y là $\large C_2H_5OH$
Từ $\large M = 39 \Rightarrow n_X = n_Y = 0,15 \Rightarrow m_Y = 6,9$ gam
Xem thêm các bài tiếp theo bên dưới
- Anđehit axetic (etanal) có công thức là: A. $\Large HCHO$. B. $\Large
- Cho 21,6 gam hỗn hợp gồm rượu etylic, axit fomic và etylenglicol tác d
- Tên gọi của $\Large C_{6}H_{5}CHO$ (chứa vòng benzen) là: A. anđehit o
- Trước đây người ta hay sử dụng chất này để bánh phở trắng và dai hơn,
- Ứng dụng nào sau đây của anđehit fomic? A. Điều chế dược phẩm. B. Tổng